
题目列表(包括答案和解析)
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 520 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5] | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
| 物质 | 大气中的含量 (体积百分比) |
温室效应 指数 |
| CO2 | 0.03 | 1 |
| H2O | 1 | 0.1 |
| CH4 | 2×10-4 | 30 |
| N2O4 | 3×10-5 | 160 |
| O3 | 4×10-6 | 2000 |
| CCl2F2 | 4.8×10-8 | 25000 |
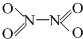 ,分子为平面结构.N2O4分子中N原子的杂化方式为
,分子为平面结构.N2O4分子中N原子的杂化方式为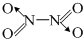
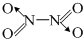
| 共价键 | C-C | C-N | C-S |
| 键能/kJ?mol-1 | 347 | 305 | 259 |
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
(11分)
(1)、下表是一些短周期元素的气态原子失去核外不同电子所需的能量(kJ·mol-1):
通过表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量 ,
X在周期表中位置:第 期, 族,Y的最高正价为 。
(2)1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5] | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
(10分)1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:

请仔细分析,回答下列有关问题:
①预测周期表中电负性最大的元素应为_____;估计钙元素的电负性的取值范围: < X < 。
②根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是
; 简述元素电负性X的大小与元素金属性、非金属性之间的关系 。
③经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com