
题目列表(包括答案和解析)
氯气是一种重要的化工原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 。
(2)资料显示:Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。

①在该实验中,甲部分的装置是 (填字母);

②乙装置中FeCl2溶液与Cl2反应的离子方程式是 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是 ;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、清毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是 ;
④该实验存在明显的缺陷,改进的方法是 。
(3)为测定漂白粉中Cs(ClO)2的质量分数,该小组将2.0g漂白粉配制成250mL溶液,取出25mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1mol·L-1Na2S2O3溶液:2Na2S2O3+I2=Na2S4O6+2NaI,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。
氯气是一种重要的化工原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 。
(2)资料显示:![]() 。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
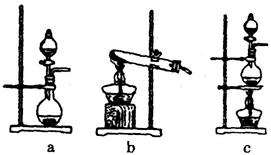
①在该实验中,甲部分的装置是 (填字母);指出a中m仪器的名称 。
![]()
![]()
②乙装置中FeCl2溶液Cl2反应的离子方程式是 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是(填加试剂的名称、至少填二种)方法 、
;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、清毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是 ;
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0g漂白粉配制成250mL溶液,取出25mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入![]() 溶液:
溶液:![]() ,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。
,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。
氯气是一种重要的化工原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 。
(2)资料显示: 。某学习小组利用此原理设
。某学习小组利用此原理设 计如图所示装置制取氯气并探究其性质。
计如图所示装置制取氯气并探究其性质。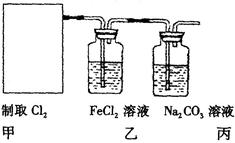
①在该实验中,甲部分的装置是 (填字母);指出a中m仪器的名称 。
|

 ②乙装置中FeCl2溶液Cl2反应的离子方程式是 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是(填
②乙装置中FeCl2溶液Cl2反应的离子方程式是 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是(填 加试剂的名称、至少填二种)方法 、
加试剂的名称、至少填二种)方法 、 溶液:
溶液: ,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。
,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。氯气是一种重要的化工原料。某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。

(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有
;
(2)装置A中盛有的试剂是 ,作用是 。
(3)若D中品红溶液褪色,则B装置中发生反应的离子方程式是
(4)证明FeBr2与Cl2发生了氧化还原反应的实验方法是 (填操作方法)。
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气。经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32- 和SO42-,对于可能存在的其他阴离子,研究小组提出以下3种假设。假设1:只存在SO32-;假设2:只存在ClO-;假设3:既不存在SO32-,也不存在ClO-。
(5)学习小组判断同时存在SO32-和ClO-是不可能的理由是 。
38.现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论。
a.3 mol/L H2SO4
b.0.01 mol/L KMnO4
c.1 mol/L BaCl2溶液
d.淀粉碘化钾溶液
e.酚酞试液
步骤一;取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B
两试管中。
步骤二:向A试管中滴加少量___________ (填序号),若溶液_________________(填现象),则假设
1成立。
步骤三:向B试管中滴加少量___________(填序号),若溶液_________________(填现象),则假设2
成立。
氯气是一种重要的化工原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 。
(2)资料显示: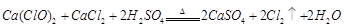 。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
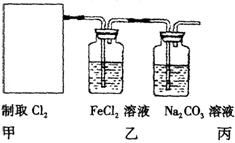
①在该实验中,甲部分的装置是 (填字母);指出a中m仪器的名称 。
②乙装置中FeCl2溶液Cl2反应的离子方程式是 。证明FeCl2与Cl2发生了氧化还原反应的实验方法是(填加试剂的名称、至少填二种)方法 、
;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、清毒的物质。已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是 ;
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0g漂白粉配制成250mL溶液,取出25mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入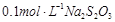 溶液:
溶液: ,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。
,共消耗20mLNa2S2O3溶液,则漂白粉中Ca(ClO)2的质量分数为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com