
题目列表(包括答案和解析)
(15分)A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图所示(部分产物省略)。请按要求回答下列问题:
(1) 若A是氯碱工业的一种重要产品,通常状况下D是一种非极性气体分子,则D的结构式为 ,A与D以物质的量3:2反应后的溶液中离子浓度的大小顺序为:
(2) 若D为某金属单质,向C的溶液中滴加AgNO3溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式为 ;将B的溶液加热蒸干再灼烧,所得固体物质的化学式为 。
(3) 若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式为 ;符合此条件的D物质可能是 (填序号)
A.H2SO4 B.CH3COOH C. NaOH D.NH3·H2O E.BaCl2
(15分)A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图所示(部分产物省略)。请按要求回答下列问题:
(1) 若A是氯碱工业的一种重要产品,通常状况下D是一种非极性气体分子,则D的结构式为 ,A与D以物质的量3:2反应后的溶液中离子浓度的大小顺序为:
(2) 若D为某金属单质,向C的溶液中滴加AgNO3溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式为 ;将B的溶液加热蒸干再灼烧,所得固体物质的化学式为 。
(3) 若D为强电解质溶液,A和k*s*5*uC在溶液中反应生成白色沉淀B,则A和k*s*5*uC反应的离子方程式为 ;符合此条件的D物质可能是 (填序号)
A.H2SO4 B.CH3COOH C. NaOH D.NH3·H2O E.BaCl2
(15分)A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图所示(部分产物省略)。请按要求回答下列问题:
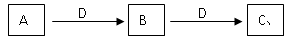
(1) 若A是氯碱工业的一种重要产品,通常状况下D是一种非极性气体分子,则D的结构式为 ,A与D以物质的量3:2反应后的溶液中离子浓度的大小顺序为:
(2) 若D为某金属单质,向C的溶液中滴加AgNO3溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式为 ;将B的溶液加热蒸干再灼烧,所得固体物质的化学式为 。
(3) 若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式为 ;符合此条件的D物质可能是 (填序号)
A.H2SO4 B.CH3COOH C. NaOH D.NH3·H2O E.BaCl2
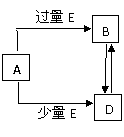 (08黄冈中学二模)(15分)已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去)。
(08黄冈中学二模)(15分)已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去)。
(1) 若A和E为单质,组成A单质的元素是自然界中形成化合物种类最多的元素。
① B属于分子 非极性 (填“极性”或“非极性”),B分子中各原子最外层 是 (填“是”或“否”)都满足8电子结构;
② 向50 mL4 mol/L的NaOH溶液中通入1.12 L B(标准状况),
反应后溶液中溶质的物质的量之比为 Na2CO3 :NaOH =1:2 (填化学式和物质的量之比);
③ 4 g A单质完全燃烧放出131.2 kJ的热量,写出表示A单质燃烧热的热化学方程式
C(s)+O2(g)= CO2(g);△H=393.6kJ/mol
(2) 若A为第三周期中的元素所形成的氯化物。
① 写出A溶液→B的离子方程式 Al3++4OH―=AlO2―+2H2O ;
② 写出A和B的溶液反应的离子方程式 Al3++3AlO2―+6H2O=4Al(OH)3↓ 。
(3) 若A为常见的金属,在E的冷、浓溶液中,A有钝化现象。已知:X为含有非极键的离子化合物,且1 mol X含有38 mol电子,向D溶液中加入与D等物质的量的X固体,恰好完全反应,写出该反应的离子方程式 4Fe2++4Na2O2+6H2O=4Fe(OH)3+O2↑+8Na+ 。
(15分)甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____________分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) 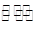 CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为____________
②下列选项能判断该反应达到平衡状态的依据的有____________
| A.2v(H2)=v(CH3OH) | B.CO的消耗速率等于CH3OH的生成速率 |
| C.容器内的压强保持不变 | D.混合气体的密度保持不变 |
| 离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
| c/mol·L﹣1 | 0.5 | 2 | 2 | 0.5 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com