
题目列表(包括答案和解析)
 30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10.随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色.
30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10.随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色.| 序号 | 操作 | 现象 |
| ① | 滴入稀硝酸溶液 | 沉淀溶解,有无色气泡产生,最终得到蓝色溶液. |
| ② | 滴入稀硫酸溶液 | 橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色 |
| 物质 | 颜色 | 物质 | 颜色 |
| 氯化铜 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 氢氧化亚铜(不稳定) | 橙黄色 |
| 碱式氯化铜 | 绿色 | 氢氧化铜 | 蓝色 |
| 氧化亚铜 | 砖红色或橙黄色 | 氯化亚铜 | 白色 |
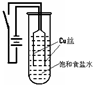
(9分)某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
【实验1】:如右下图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细。电解开始30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10。随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色。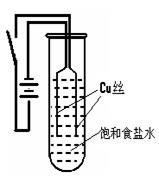
【实验2】:将实验1中试管底部的橙黄色沉淀取出,分装在两
支小试管中,以后的操作和现象如下:
| 序号 | 操作 | 现象 |
| ① | 滴入稀硝酸溶液 | 沉淀溶解,有无色气泡产生,最终得到蓝色溶液。 |
| ② | 滴入稀硫酸溶液 | 橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色 |
| 物质 | 颜色 | 物质 | 颜色 |
| 氯化铜 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 氢氧化亚铜 (不稳定) | 橙黄色 |
| 碱式氯化铜 | 绿色 | 氢氧化铜 | 蓝色 |
| 氧化亚铜 | 砖红色或橙黄色 | 氯化亚铜 | 白色 |
某同学对Cu的常见化合物的性质进行实验探究,研究的问题和过程如下:
(1)为探究Cu(OH)2是否和Al(OH)3一样具有两性,除选择Cu(OH)2外,必须选用的试剂为__(填序号)
a.氨水 b.氢氧化钠溶液 c.稀硫酸 d.冰醋酸
(2)为探究不同价态铜的稳定性,进行如下实验:
①将CuO粉末加热至1000℃以上完全分解成红色的Cu2O粉末,该实验说明:在高温条件下,+l价的Cu比+2价Cu更 (填“稳定”或“不稳定”)。
②向Cu2O中加适量稀硫酸,得到蓝色溶液和一种红色固体,该反应的离子化学方程式为____________,由此可知,在酸性溶液中,+1价Cu比+2价Cu更 (填“稳定”或“不稳定”)。
(3)为了探究氨气能否和氢气一样还原CuO,他根据所提供的下列装置进行实验(夹持装置未画),装置A产生氨气,按气流方向连接各仪器接口,顺序为a→____→____→____→____→____→____→h

①实验开始时,打开分液漏斗的活塞K,发现浓氨水没有滴下,如果各仪器导管均没有堵塞,则可能的原因是_______________________________________。
②实验结束后,装置B中固体由黑色变为红色,装置E中收集到无色无味的气体,在空气中无颜色变化,点燃的镁条可以在其中燃烧,则B装置中发生的化学方程式为______________________。
③装置C中的球形装置的作用是_________________。
(9分)某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
【实验1】:如右下图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细。电解开始30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10。随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色。
【实验2】:将实验1中试管底部的橙黄色沉淀取出,分装在两
支小试管中,以后的操作和现象如下:
| 序号 | 操作 | 现象 |
| ① | 滴入稀硝酸溶液 | 沉淀溶解,有无色气泡产生,最终得到蓝色溶液。 |
| ② | 滴入稀硫酸溶液 | 橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色 |
阅读资料:常见铜的化合物颜色如下:
| 物质 | 颜色 | 物质 | 颜色 |
| 氯化铜 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 氢氧化亚铜 (不稳定) | 橙黄色 |
| 碱式氯化铜 | 绿色 | 氢氧化铜 | 蓝色 |
| 氧化亚铜 | 砖红色或橙黄色 | 氯化亚铜 | 白色 |
请回答下列问题:
(1)铜的常见正化合价为________、_______,最终试管底部橙黄色沉淀的化学式_______________。
(2) 电解开始30s内,阴极上发生的反应为: 、阳极上发生的反应为: 。
(3)写出实验2中①、②的离子方程式:①_______________;②___________________。
(9分)某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
【实验1】:如右下图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细。电解开始30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10。随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色。
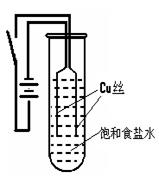
【实验2】:将实验1中试管底部的橙黄色沉淀取出,分装在两
支小试管中,以后的操作和现象如下:
|
序号 |
操作 |
现象 |
|
① |
滴入稀硝酸溶液 |
沉淀溶解,有无色气泡产生,最终得到蓝色溶液。 |
|
② |
滴入稀硫酸溶液 |
橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色 |
阅读资料:常见铜的化合物颜色如下:
|
物质 |
颜色 |
物质 |
颜色 |
|
氯化铜 |
固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 |
氢氧化亚铜 (不稳定) |
橙黄色 |
|
碱式氯化铜 |
绿色 |
氢氧化铜 |
蓝色 |
|
氧化亚铜 |
砖红色或橙黄色 |
氯化亚铜 |
白色 |
请回答下列问题:
(1)铜的常见正化合价为________、_______,最终试管底部橙黄色沉淀的化学式_______________。
(2) 电解开始30s内,阴极上发生的反应为: 、阳极上发生的反应为: 。
(3)写出实验2中①、②的离子方程式:①_______________;②___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com