
题目列表(包括答案和解析)
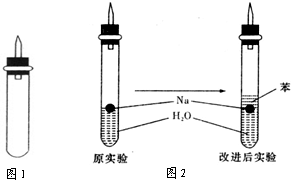 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.为点燃上述三个反应生成的H2,他们设计了如图所示的装置图:
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.为点燃上述三个反应生成的H2,他们设计了如图所示的装置图:某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液。为点燃上述三个反应生成的H2,他们设计了如右图所示的装置图:
![]()
]请回答下列问题:
(1)写出Al和NaOH溶液反应的离子方程式_______________________________。
(2)在点燃H2之前必须先进行____________________________________________。
(3)实验小组在点燃用上述装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量又太少。于是他们准备增加钠的用量,可教师说太危险,你认为产生危险的原因是___________________________。
(4)实验小组查阅钠、苯(一种不溶于水的液态有机物)、水的密度分别为0.97 g·mL-1、0.88 g·mL-1、1.00 g·mL-1,并据此对实验进行了改进。在改进后的实验中H2的生成速率______________________。(填“减慢”或“加快”)
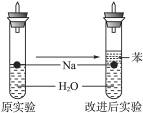
(5)2.3 g钠投入20 mL水中完全反应放出的气体在标准状况下的体积是_____________,所得溶液的物质的量浓度是______________________。(不计溶液体积的变化)
(18分)Ⅰ测定水中溶解氧的方法是:在水中加入硫酸锰及氢氧化钠和碘化钾溶液,生成氢氧化锰沉淀。氢氧化锰性质极不稳定,迅速与水中溶解氧化合生成锰酸锰:
2MnSO4+4NaOH=2Mn(OH)2↓+2Na2SO4--------------①
2Mn(OH)2+O2=2H2MnO3---------------------------②
H2MnO3十Mn(OH)2=MnMnO3↓+2H2O------③
加入硫酸溶液,使沉淀(MnMnO3)与溶液中所加入的碘化钾发生反应,
2KI+H2SO4=2HI+K2SO4--------------------------- --------④
MnMnO3+2H2SO4+2HI=2MnSO4+I2+3H2O ----—⑤
用已知浓度的Na2S2O3溶液滴定生成的碘,根据消耗的Na2S2O3的体积可以测定水中溶氧量(mg/L)
I2+2Na2S2O3=2NaI+Na2S4O6
测定中,用移液管取50.00 mL水样,迅速加入预先配置好的MnSO4和NaOH混合溶液,再加入KI溶液,立即塞好塞子,震荡使反应完全。打开塞子,迅速加入适量的稀硫酸,期间发生①—⑤反应生成单质碘。用0.10mol/LNa2S2O3溶液滴定生成的碘,消耗了2.68mL Na2S2O3溶液。
已知:H2S2O3 为弱酸
回答下列问题:
(1)盛放Na2S2O3溶液的滴定管种类为
(2)该滴定的指示剂为 ,滴定时,溶液由 色到 色,且半分钟内颜色不再变化即达到滴定终点
(3)下列操作和该滴定有关并会导致测定水中溶氧偏高的是( )
A滴定前滴定管尖嘴无气泡,滴定结束尖嘴有气泡 B锥形瓶用待装液润洗
C滴定管读数开始平视,滴定结束时立即平视读数 D酸式滴定管没有用待装液润洗
(4)水中溶氧量为 mg/L水。
Ⅱ50.00mL0.50mol/L盐酸跟50.0mL0.55mol/L氢氧化钠溶液在下图装置中进行中和反应,通过测定反应前盐酸和氢氧化钠溶液各自的温度和中和过程中混合液的最高温度可计算中和热.试回答下列问题.
(1)该实验装置设计中缺少的仪器的名称为
(2)若实验测得放出热量为1.43kJ,写出表示中和热的热化学方程式
(3)改用60.0mL0.5mol/L盐酸跟50.0mL0.55mol/L氢氧化钠溶液进行反应,与上述实验相比,所放热量 等,所求中和热数值 等。(填“相等,不相等”)
(1) 在微生物作用的条件下,NH4+ 经过两步反应被氧化成NO3- 。两步反应的能量变化示意图如下:


①第一步反应是 _________ 反应(选题“放热”或“吸热”),判断依据是
________________________________________
②1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是
________________________
(2) 用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.20mol·L-1的氢氧化钠溶液(指示剂为酚酞)滴定,滴定结果如下:
| 实验编号 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.40mL |
| 第二次 | 3.00mL | 21.10mL |
| 第三次 | 0.20mL | 20.40mL |
| 第四次 | 0.00mL | 18.20mL |
①滴定管在使用之前需要先___________________,再洗涤和润洗
②判断滴定终点的现象是
③根据以上数据可以计算出盐酸的物质的量浓度为 _______ mol·L-1(小数点后保留两位有效数字)。
④以下操作可能造成测定结果偏高的是 (填写序号)。
A.滴定前,碱式滴定管尖嘴有气泡,滴定后消失
B.滴定前读数正确,达到滴定终点后,俯视读数
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗
E.未用标准液润洗酸式滴定管
(3) 由pH=3的HA(弱酸)与pH=11的NaOH溶液等体积混合,所得溶液中离子浓度大小的顺序为______________________________________
Fridel—Crafts反应是向苯环上引入烷基最重要的方法,在合成上有很大的实用价值,该反应可以简单表示如下:Ar+RX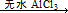 ArR+HX
△H<0(Ar表示苯基)。某化学兴趣小组在实验室先利用叔丁醇(沸点90.70C)与盐酸反应制得叔丁基氯(沸点 500C),再利用Fridel—Crafts反应原理制备对叔丁基苯酚(熔点990C)。反应流程及实验装置如下图所示:
ArR+HX
△H<0(Ar表示苯基)。某化学兴趣小组在实验室先利用叔丁醇(沸点90.70C)与盐酸反应制得叔丁基氯(沸点 500C),再利用Fridel—Crafts反应原理制备对叔丁基苯酚(熔点990C)。反应流程及实验装置如下图所示:
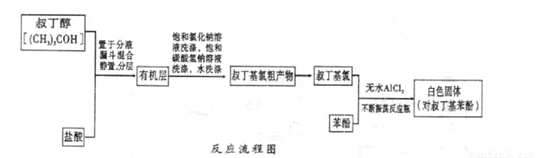

试回答下列问题:
(1)实验装置烧杯中漏斗的作用是________。
(2)巳知Fridel—Cxafts反应是放热反应,为防止叔丁基氣的蒸气被大量的HCl气体带走而影响产率,应将锥形瓶置于_______(填“冷水浴”或“热水浴”)中。
(3)有机层中加入饱和氣化钠溶液及饱和碳酸氢钠溶液的作用可能是_______。通过 操作可将叔丁基氯粗产物转化为较为纯净的叔丁基氯。
(4)某同学因去掉该制备装置中的氣化钙干燥管,发现产率很低(观察不到对叔丁基苯酚白色固体)且锥形瓶中有大量的白雾,他推测是作催化剂的AlCl3发生强烈水解所致,该 同学设计如下实验方案进行验证,请完成下表内容。
|
实验方案 |
实验现象 |
能否说明水解 |
|
①将锥形瓶中白雾通入HNO3酸化的AgNO3溶液 |
|
|
|
②将充分冒白雾后的液体抽滤,得不溶性固体,将 固体分成两份, 。 |
两份固体均溶解 |
|
(5)若上述同学称取了9.4g苯酚与适量叔丁基氯反应,从反应液中提取出对叔丁基苯酚,将其配成100mL乙醇溶液,移取25.00mL溶液,滴定,消耗NaOH物质的量为5×10-4moL,则以苯酚为基准计算对叔丁基苯酚产率的表达式为_______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com