
题目列表(包括答案和解析)
| 压强MPa 转化率% 温度℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
氧化二氯是黄棕色具有强烈刺激性的气体。它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1∶100)同时反应生成次氯酸溶液。制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO·HgCl2)。装置如图,仅铁架台和夹持仪器已略去。

部分物质的有关物理数据如下:
|
化学式 |
熔点(单位:℃) |
沸点(单位:℃) |
|
N2 |
-209.86 |
-195.8 |
|
O2 |
-218.4 |
-183 |
|
CO2 |
-57 |
/ |
|
NH3 |
-77.3 |
-33.35 |
|
Cl2 |
-101 |
-34.6 |
试回答:
(1)A中深色固体与无色液体制备气体的离子方程式: 。
(2)B中盛有液体c是饱和 ,C中的液体d是浓硫酸。?
(3)氧化二氯制备出之后,要冷却为固态才便于操作和贮存,则E中的保温瓶中盛有致冷剂,它应是
(在干冰、冰水、液态空气、液氨中选择)。在E的内管得到的Cl2O中可能含有的主要杂质是反应物中过量的 。
(4)装置D、E间的连接方式与A、B、C间的连接方式有明显的区别,这区别是D、E中无 管、塞,用这些不同的连接方式的主要理由是氧化二氯接触有机物而 。
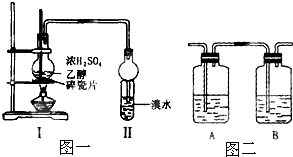
(12分)化学兴趣小组用下图所示装置进行探究实验。以验证产物中有乙烯生成且乙烯具有不饱和性。
当温度迅速上后,可观察到试管中的溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。(已知:二溴乙烷密度2.18 g·cm-3,不易溶于水,易溶于醇、醚、丙酮等有机溶剂)。
请回答下列问题:
(1)该实验中生成乙烯的化学方程式:_______________________________________。
(2)甲同学认为:该混合液体反应复杂,溴水褪色的现象不能证明反应中有乙烯生成及乙烯具有不饱和性。下列理由中正确的是 __________(填选项)。
A.乙烯与溴水易发生取代反应 B.使溴水褪色的反应,未必是加成反应
C.使溴水褪色的物质,未必是乙烯 D.浓硫酸氧化乙醇生成乙酸,也会使溴水褪色
(3)乙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加了如下图所示装置。
则A中的试剂应为 ___________ , B中的试剂为____________。
(4)丙同学经过观察后认为:试管中另一现象可证明反应中有乙烯生成,这个现象是:
______________________;为验证这一反应是加成反应而不是取代反应,可用pH试纸来测试反应前后溶液的酸性变化,原理是:_____________________。
(5)处理上述实验后烧瓶中废液,最合理的方法是______________(填选项)。
A.废液经冷却后倒入下水道中 B.废液倒入空废液缸中
C.将水加入烧瓶中稀释后倒入废液缸 D.废液倒入盛有水的塑料桶中,经处理后再倒入下水道
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com