
题目列表(包括答案和解析)


| ||
| △ |
| ||
| △ |
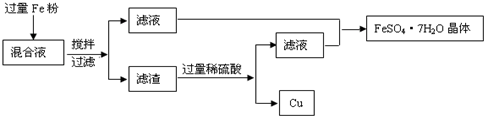
| 淀粉酶 |
| 酒化酶 |


| ||
| ||
| ||
| ||

X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,Y和Z的单质可以通过分离液态空气的方法大量制得,且XZ2与Y2Z互为等电子体。含U的化合物的焰色为紫色。试回答下列问题:
(1)U单质的原子堆积方式为__________________,Y的价电子排布式为__________________。
(2)化合物甲由Z、U两元素组成,其晶胞如图所示。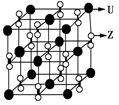
①甲的化学式为____________。
②下列有关该晶体的说法中正确的是________(选填选项字母)。
A.每个晶胞中含有14个U+ 和13个Z2-
B.晶体中每个U+ 周围距离最近的U+ 有6个
C.该晶体属于离子晶体
③甲的密度为a g·cm-3,则晶胞的体积是_____________ m3(只要求列出计算式,阿伏加德罗常数的值用NA表示)。
(9分)食品安全关系国计民生,影响食品安全的因素很多。
(1)聚偏二氯乙烯的结构简式为
 ,具有超强的阻隔性能,可作为保鲜食品的包装材料,它是由
(写结构简式)发生加聚反应制得的。
,具有超强的阻隔性能,可作为保鲜食品的包装材料,它是由
(写结构简式)发生加聚反应制得的。
(2)假酒中往往甲醇含量超标,若从乙醇和甲醇的混合液中分离出甲醇,下列方法正确的是(填序号) 。
①过滤 ②分液 ③蒸馏 ④结晶
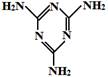
(3)毒奶粉中常加有害物质三聚氰胺(结构简式如图所示),已知1 g三聚氰胺晶体完全燃烧生成N2、CO2和液态水时,放出a kJ热量,1 mol H2O(g)转化为1 mol H2O(l)时放出44 kJ热量,则在101 kPa 120℃三聚氰胺晶体完全燃烧时生成N2、CO2和水蒸气的热化学方程式为:
(4)劣质植物油中的亚油酸(C18H32O2)含量很低,下列有关亚油酸的叙述正确的是(填序号) 。
① 亚油酸分子中的含氧官能团为羧基
② 亚油酸甘油酯完全硬化时与消耗H2的物质的量之比为1∶2
③ 亚油酸可发生氧化反应、加成反应、取代反应
④ 可用酸性KMnO4溶液检验亚油酸甘油酯的皂化反应是否完全
(5)在淀粉中加入吊白块制得粉丝有毒,吊白块又称雕白粉,化学名称为二水合次硫酸氢钠甲醛(化学式为:NaHSO2·CH2O·2H2O,相对分子质量为:154),有漂白作用。已知某种含吊白块的粉丝(不考虑吊白块的损失)1 g中含硫0.32 %,则每千克这种粉丝中含吊白块的质量为 g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com