
题目列表(包括答案和解析)
| 质量 分数 |
0% (纯水) |
1% | 4% | 10% | 16% | 24% | 32% | 36% | 44% | 49% | 60% | 98% |
| 密度 | 1.00 | 1.01 | 1.02 | 1.07 | 1.11 | 1.17 | 1.24 | 1.27 | 1.34 | 1.39 | 1.50 | 1.84 |


【2009?广州】实验室用98%的浓硫酸配制成稀硫酸,并与锌粒反应制取氢气。
(1)查阅资料。
20℃时不同质量分数硫酸的密度(g/mL)
| 质量 分数 | 0% (纯水) | 1% | 4% | 10% | 16% | 24% | 32% | 36% | 44% | 49% | 60% | 98% |
| 密度 | 1.00 | 1.01 | 1.02 | 1.07 | 1.11 | 1.17 | 1.24 | 1.27 | 1.34 | 1.39 | 1.50 | 1.84 |
分析以上数据,可以得出结论(写2条)
① ;
② ;
(2)计算。
配制200g24.5%的稀硫酸,需 g98%浓硫酸和 g水。实际操作时,取98%浓硫酸 mL(精确到1mL);
(3)配制稀硫酸。
分别用量筒量取所需水和浓硫酸,先将 倒入烧杯中,然后
;
(4)制取氢气。
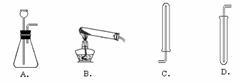
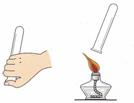 ①下图中可用于制取、收集氢气的装置是(填字母) ;
①下图中可用于制取、收集氢气的装置是(填字母) ;
②检验氢气纯度的方法如图所示,标明氢气不纯的现象是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com