化学是一门以实验为基础的科学.
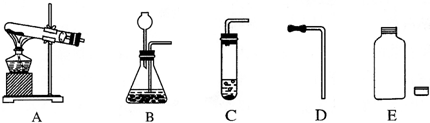
(1)根据图1回答:①写出a的名称
试管
试管
;②在连接c和d时,使d较易插入c中的措施是
用水湿润
用水湿润
;
(2)采用图2所示操作可能造成的后果之一是
试管破裂
试管破裂
;
(3)利用图3装置(夹持装置未画出)能进行的实验是
CD
CD
(选填序号);A.用高锰酸钾制氧气; B.用石灰石与稀盐酸制二氧化碳;C.用锌与稀硫酸制氢气; D.用双氧水与二氧化锰制氧气.
(4)图3中的气体发生装置虽然简单,操作方便,但无法控制反应速率.请从图4中选取
B或C
B或C
(选填序号)与图1中a组装成新的气体发生装置,以达到控制反应速率的目的.
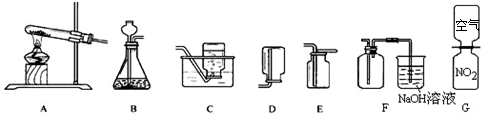
(5)实验室用图5中A装置制氧气的化学方程式是
,反应结束后冷却,往试管中加入足量的水,搅拌、过滤,得到黑色粉末.该黑色粉末与过氧化氢接触有大量气泡产生,反应的化学方程式是
,黑色粉末在反应中的作用是
催化
催化
.用E装置收集氧气的依据是
氧气的密度大于空气的密度
氧气的密度大于空气的密度
,检验氧气是否集满的方法是
将带火星的木条放在集气瓶口,木条复燃说明已满
将带火星的木条放在集气瓶口,木条复燃说明已满
.
(6)机动车排放的尾气是空气的重要污染源,其成分之一是NO.某化学兴趣小组的同学在查阅资料后得知:①NO常温下是一种无色、难溶于水的气体,它的密度比空气略大;②NO常温下能与氧气迅速反应,生成红棕色的NO
2气体:2NO
2+O
2═2NO
2;③实验室常用铜与稀硝酸反应制取NO:3Cu+8HNO
3(稀)═3Cu(NO
3)
2+2NO↑+4X. 根据以上信息完成下列问题:
①物质X的化学式为
H2O
H2O
.
②若选择合适的装置来制取并收集NO气体,你选择图5中的发生装置是
B
B
,收集装置是
C
C
.
③该小组的同学通过查阅资料还得知:a.NO容易和血红蛋白结合而使人中毒;b.NO能抗击侵入人体的微生物,并能阻止癌细胞的繁殖和肿瘤细胞的扩散.综合分析①和②的信息,你得到的启示是
任何物质都具有两面性
任何物质都具有两面性
④某化工厂准备生产Cu(NO
3)
2,以铜和稀硝酸为主要原料设计了两种方案:
方案一:3Cu+8HNO
3(稀)═3Cu(NO
3)
2+2NO↑十4X;
方案二:2Cu+O
22CuO,CuO+2HNO
3═Cu(NO
3)
2+H
2O.从环境保护的角度考虑,你认为较合理的方案是
方案二
方案二
.从经济角度考虑选择此方案的理由是
产生相同质量的硝酸铜所消耗的稀硝酸少
产生相同质量的硝酸铜所消耗的稀硝酸少
.
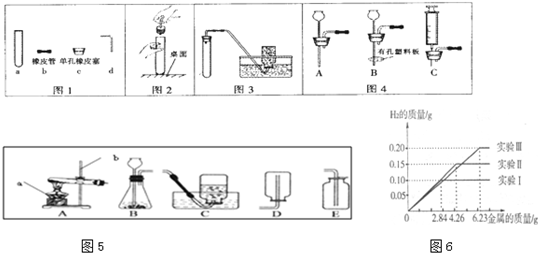
(7)某化学调查小组的同学到钢铁厂做社会调查.他们抽取组成完全相同的质量为2.84g、4.26g、6.23g的三份钢样(假设钢样中只含铁和碳),分别加入100g稀硫酸中进行实验(实验I、Ⅱ、Ⅲ),充分反应后,将得到的实验数据绘制出如图象图6:试回答(计算结果精确到0.1%):
①写出实验中有关的化学方程式:
Fe+H2SO4═FeSO4+H2↑
Fe+H2SO4═FeSO4+H2↑
.
②实验I中铁参加反应的质量为
2.8g
2.8g
.
③稀硫酸完全参加反应的实验中,反应后溶液中溶质的质量分数是多少.