
题目列表(包括答案和解析)
甲醇是一种重要的可再生能源,工业上可用CO和H2合成。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=—283 kJ·mol—1
CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l) △H=—725kJ·mol—1
若要求得CO(g)+2H2(g)=CH3OH(l)的△H,还需要知道反应(用化学方程式表示) 的焓变。
(2)在Cu2O/ZnO做催化剂的条件下,将CO(g)和H2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图。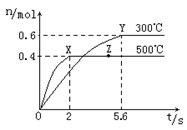
根据题意回答下列问题:
①反应达到平衡时,平衡常数表达式K= ;
升高温度,K值 (填“增大”、“减小”
或“不变”)。
②在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
③若其它条件不变,对处于Z点的体系,将体积压缩至原来的1/2,达到新的平衡后,下列有关该体系的说法正确的是 。
a.氢气的浓度与原平衡比减少 b.正、逆反应速率都加快
c.甲醇的物质的量增加 d.重新平衡时n(H2) /n(CH3OH)增大
④据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因是: (写出相关的化学方程式并辅以必要的文字说明)。
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)![]() CH3OH(g) ΔH<0.
CH3OH(g) ΔH<0.
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡.
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是________(填字母).
A.升高温度
B.增大压强
C.通入CO
D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡________(填字母).
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
作出此判断的理由是________
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的.实验数据见下表:
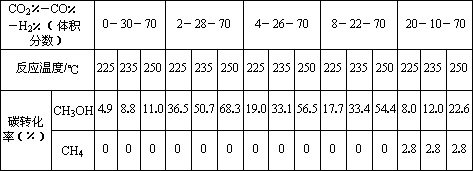
(3)由上表数据可得出多个结论.
结论一:在一定条件下,反应温度越高,碳转化率________.
结论二:________________________________
(4)为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验.
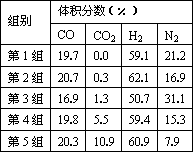
进行该验证实验时,控制不变的因素有________、________、________等.
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)![]() CH3OH(g)ΔH<0.
CH3OH(g)ΔH<0.
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡.
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是________(填字母).
A.升高温度
B.增大压强
C.通入CO
D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡________(填字母).
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
作出此判断的理由是________________________
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的.实验数据见下表:
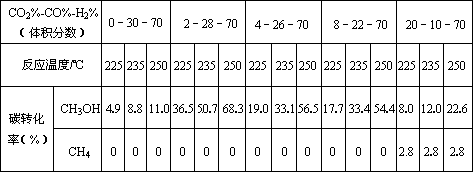
(3)由上表数据可得出多个结论.
结论一:在一定条件下,反应温度越高,碳转化率__________.
结论二:_____________________________________________
(4)为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验.
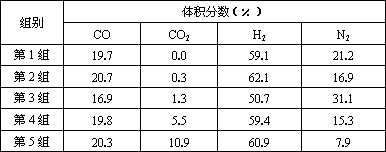
进行该验证实验时,控制不变的因素有________________、_________________、____________________________________________等.
(12分)(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题:
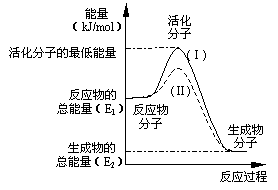 ①图中所示反应是_____________(填“吸热”
①图中所示反应是_____________(填“吸热”
或“放热”)反应,该反应____________
(填“需要”或“不需要”)加热,该反应的
△H=____________(用含E1、E2的代数式表示)。
②已知热化学方程式:H2(g)+1/2O2(g)=H2O(g);
△H=-241.8 kJ/mol。该反应的活化能为
167.2kJ/mol,则其逆反应的活化能为____________。
③对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,
活化能大大降低,活化分子的百分数增多,反应速率明显加快,你认为最可能的原因是_________ ____________________________________________。
(2)随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求。
①有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
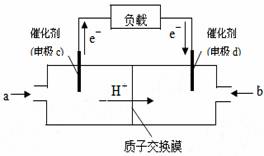 ②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。
②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。
甲醇在催化剂作用下提供质子和电子,电子经外电路、
质子经内电路到达另一极与氧气反应,电池总反应为:
2CH3OH+3O2=2CO2+4H2O。则c电极是
(填“正极”或“负极”),c电极上发生的电极反应式
是 。
面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)  CH3OH(g) ΔH1=-90 kJ·mol-1
CH3OH(g) ΔH1=-90 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:_______________________。
(2)在容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。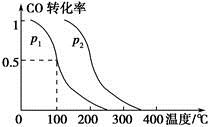
①p1________p2(填“大于”、“小于”或“等于”);
②在其他条件不变的情况下,再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”,下同),平衡常数________。
(3)已知在T ℃时,CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________________________
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________________________
此时刻v正________v逆(填“>”或“<”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com