
题目列表(包括答案和解析)
组成生命细胞的11种宏量元素(约占人体总质量的99.97%),全部位于周期表的前20号.其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素.
(1)这六种元素中除H、C、O、P、S外,应该还有________(写元素符号),它的原子最外层共有________种不同运动状态的电子;与它同周期,且单质熔点最高的元素在周期表中的位置________.
(2)糖类是人体获得能量的来源之一.已知
1 mol葡萄糖在人体内完全氧化为二氧化碳和水,放出2804 kJ的热量,该反应的热化学方程式________.(3)CO2是一种温室气体,它的电子式为________,将其转变其他化工原料,必须破坏的化学键属于________(填“极性”或“非极性”)键.
(4)元素周期表中元素的性质存在递变规律,下列关系正确的是________(填序号).
a.离子半径:S2->Na+>O2->H+
b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3
d.还原性:PH3>H2S>HCl>HF
(5)下表为部分非金属元素与氢形成共价键的键长与键能数据:

根据表中数据,归纳共价键键能与键长的关系________.
组成生命细胞的11种宏量元素(约占人体总质量的99.97%),全部位于周期表的前20号.其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素.
(1)这六种元素中除H、C、O、P、S外,应该还有________(写元素符号),它的原子最外层共有________种不同运动状态的电子;与它同周期,且单质熔点最高的元素在周期表中的位置________.
(2)糖类是人体获得能量的来源之一.已知1 mol葡萄糖在人体内完全氧化为二氧化碳和水,放出2804 kJ的热量,该反应的热化学方程式________.
(3)CO2是一种温室气体,它的电子式为________,将其转变其他化工原料,必须破坏的化学键属于________.(填“极性”或“非极性”)键.
(4)元素周期表中元素的性质存在递变规律,下列关系正确的是________(填序号).
a.离子半径:S2->Na+>O2->H+
b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3
d.还原性:PH3>H2S>HCl>HF
(5)下表为部分非金属元素与氢形成共价键的键长与键能数据:
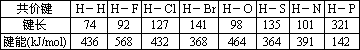
根据表中数据,归纳共价键键能与键长的关系________.
(13分)有效地利用现有新能源和开发新能源已受到各国的重视。
(1)可用改进汽油组成的办法来改善汽油的燃烧性能。例如,在汽油中加入乙醇来生产“无铅汽油”。乙醇的分子式为C2H6O,试根据C、H、O成键的特点,写出C2H6O所有可能的结构式或结构简式 。
(2)天然气的主要的成分是甲烷,其燃烧产物无毒、热值高、管道输送方便,将成为我国西部开发的重点之一。能说明甲烷是正四面体而非正方形平面结构的理由是 。(填写编号,多选倒扣分)
①其一氯取代物不存在同分异构体 ②其二氯取代物不存在同分异构体
③其三氯取代物不存在同分异构体 ④其四氯取代物不存在同分异构体
(3)将两个石墨电极插人KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极电极反应式是:CH4 + 10 OH―― 8e-= CO32-+ 7 H2O;通入O2的一极,其电极反应式是 。已知4g甲烷完全燃烧生成CO2气体和液态水时放出222.5kJ的热量,则甲烷燃烧的热化学方程式为 ;
(4)氢能是人类未来的理想能源。1980年我国首次制成一辆燃氢汽车,乘员12人,以50km/h行驶了40km。为了有效发展民用氢能源,首先必须制得廉价的氢气。下列既可供开发又消耗较低经济的制氢方法是 (填写编号,多选倒扣分)
①电解水 ②锌和稀硫酸反应 ③光解海水
其次,制得纯氢气后,还需要解决的问题是 。(写出其中的一个)
磷酸氢二铵[(NH4)2HPO4]可用作复合肥料。关于该物质的下列说法不正确的是( )
A.HPO42-中含有共价键,其中P的化合价为+5价
B.是一种离子化合物,其中铵根离子的电子式为
C.该化合物中所有原子均满足8电子稳定结构
D.其中P元素的质量分数比N元素的质量分数高
【解析】HPO42-中的元素全部是非金属元素,因此形成的化学键是共价键,H是+1价的,O是-2价的,所以P是+5价的,A正确。铵盐都是离子化合物,B正确。H元素不可能满足8电子稳定结构,C是错误的。P的相对原子质量是31,而2个N原子才是28,所以选项D是正确的。答案选C。
磷酸氢二铵[(NH4)2HPO4]可用作复合肥料。关于该物质的下列说法不正确的是( )
A.HPO42-中含有共价键,其中P的化合价为+5价
B.是一种离子化合物,其中铵根离子的电子式为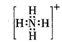
C.该化合物中所有原子均满足8电子稳定结构
D.其中P元素的质量分数比N元素的质量分数高
【解析】HPO42-中的元素全部是非金属元素,因此形成的化学键是共价键,H是+1价的,O是-2价的,所以P是+5价的,A正确。铵盐都是离子化合物,B正确。H元素不可能满足8电子稳定结构,C是错误的。P的相对原子质量是31,而2个N原子才是28,所以选项D是正确的。答案选C。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com