
题目列表(包括答案和解析)
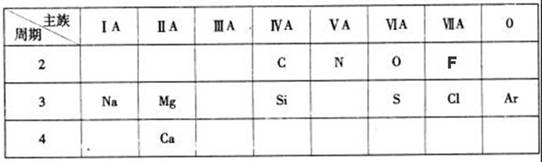
(12分)下表是元素周期表的一部分,针对所给的11种元素,完成下列各小题。
(1)化学性质最不活泼的元素是 (填元素名称);
(2)Cl原子结构示意图为 ;
(3)第三周期元素中,最高价氧化物对应水化物碱性最强的是 (填化学式);
(4)O和N中,原子半径较大的是 ;
(5)“高钙牛奶”中的钙是指 (填“元素”或“单质”);
(6)Cl的气态氢化物的稳定性比F的气态氢化物 (填强或弱);
(7)常温下为红棕色气体的氧化物的化学式是 。
(8)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为 ;
(9)S元素形成的一种氢化物的化学式是 ,该物质中H元素与S元素的质量比
m(H):m(S)= 。(相对原子质量:H-1 S-32)
【解析】考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可知最不活泼的应该是稀有气体元素Ar;Cl属于第三正确第 ⅦA,所以其原子结构示意图为;同周期元素自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。在第三周期中最活泼的金属是Na,所以氢氧化钠的碱性最强,N的原子半径大于O的原子半径;牛奶是混合物,所以“高钙牛奶”中的钙是指元素,而不是单质;同主族元素自上而下非金属性逐渐减弱,金属性逐渐增强,氯化氢的稳定性弱于氟化氢的;常温下为红棕色气体的氧化物的化学式是NO2;电解熔融氯化镁生成物是镁和氯气;S是第ⅥA,最低价是-2价,所以氢化物的化学式为H2S,其中H元素与S元素的质量比是(1×2)︰32=1︰16。
(12分)下表是元素周期表的一部分,针对所给的11种元素,完成下列各小题。
(1)化学性质最不活泼的元素是 (填元素名称);
(2)Cl原子结构示意图为 ;
(3)第三周期元素中,最高价氧化物对应水化物碱性最强的是 (填化学式);
(4)O和N中,原子半径较大的是 ;
(5)“高钙牛奶”中的钙是指 (填“元素”或“单质”);
(6)Cl的气态氢化物的稳定性比F的气态氢化物 (填强或弱);
(7)常温下为红棕色气体的氧化物的化学式是 。
(8)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为 ;
(9)S元素形成的一种氢化物的化学式是 ,该物质中H元素与S元素的质量比
m(H):m(S)= 。(相对原子质量:H-1 S-32)
【解析】考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可知最不活泼的应该是稀有气体元素Ar;Cl属于第三正确第 ⅦA,所以其原子结构示意图为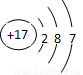 ;同周期元素自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。在第三周期中最活泼的金属是Na,所以氢氧化钠的碱性最强,N的原子半径大于O的原子半径;牛奶是混合物,所以“高钙牛奶”中的钙是指元素,而不是单质;同主族元素自上而下非金属性逐渐减弱,金属性逐渐增强,氯化氢的稳定性弱于氟化氢的;常温下为红棕色气体的氧化物的化学式是NO2;电解熔融氯化镁生成物是镁和氯气;S是第ⅥA,最低价是-2价,所以氢化物的化学式为H2S,其中H元素与S元素的质量比是(1×2)︰32=1︰16。
;同周期元素自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。在第三周期中最活泼的金属是Na,所以氢氧化钠的碱性最强,N的原子半径大于O的原子半径;牛奶是混合物,所以“高钙牛奶”中的钙是指元素,而不是单质;同主族元素自上而下非金属性逐渐减弱,金属性逐渐增强,氯化氢的稳定性弱于氟化氢的;常温下为红棕色气体的氧化物的化学式是NO2;电解熔融氯化镁生成物是镁和氯气;S是第ⅥA,最低价是-2价,所以氢化物的化学式为H2S,其中H元素与S元素的质量比是(1×2)︰32=1︰16。
下表由元素周期表的前三周期去掉副族上方空区域后组合而成,表中虚线处为ⅡA、ⅢA
族的连接处。请用相应的化学用语回答下列问题:
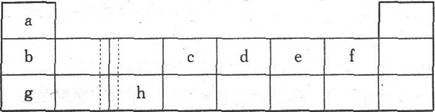
(1)h的单质能与g元素的最高价氧化物对应的水化合物的溶液反应,请写出该反应的离子方程式___________________________
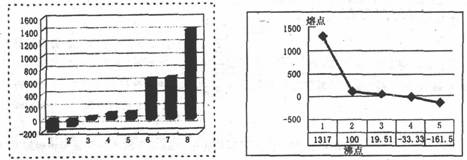
(2)上左图是第三周期8种元素按单质熔点(℃)大小顺序绘制的柱形图(已知柱形“l”代
表Ar),则其中序列“2”原子的结构示意简图为_________,“8”原子的电子排布式为________。
(3)上右图是b、c、d、e.f的氢化物的沸点直角坐标图,序列"5"氢化物的化学式为_________,序列“1”的氢化物的电子式:_________。
(4)单质a和单质e可以设计为新型燃料电池,电解质为KOH溶液,则单质a在该燃料电池的________极发生电极反应,电极反应式为________。
下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA,ⅢA族的连接处。请用相应的化学用语回答下列问题:
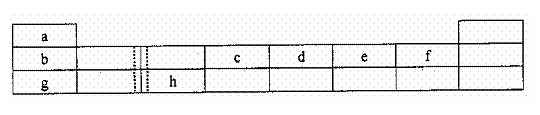
(1)写出由e形成的两种带有相同电荷数阴离子的符号: 、 。
(2)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式 。

(3)上左图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则共中柱形“8”代表 。(填化学式)
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(上右图),序列“5”的氢化物的名称是 ,序列“2”的氢化物的结构式为 。
(5)单质a和单质e可以设计为新型燃料电池,电解质为KOH溶液,则单质a在该燃料电池的 极发生电极反应,电极反应式为 。
(14分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处。请用相应的化学用语回答下列问题:
| a | | | | | | | |
| b | | | c | d | e | f | |
| g | | h | | | | | |

1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
C
B
C
A
D
B
C
C
D
C
B
A
C
BC
A
D
D
AB
AC
B
C
 22.(14分)
22.(14分)
(1) ①x-m关系曲线如图所示 (3分)
②0-4.9 (2分)
25.0 (2分)
(2)① C(2分) E(2分)
② 如图(3分)

23.(15分)
解:(1)取物体的运动方向为正,由平衡条件有  …… ①(3分)
…… ①(3分)
 ……②(1分)
……②(1分)
又 ………………③(1分)
………………③(1分)
所以有 =0.5 ……④(2分)
=0.5 ……④(2分)
(2)由牛顿第二定律有
 …………⑤(2分)
…………⑤(2分)
 =
=
据 有 ………… (2分)
有 ………… (2分)
 =
=
 或:设撤去拉力后,金属块在桌面上还能滑行的距离为s,
或:设撤去拉力后,金属块在桌面上还能滑行的距离为s,
则根据动能定理有 (5分)
(5分)
解得:
 =
=
24.解析:
(1)运动轨迹如图所示 (4分)
(2)带电粒子在电场中加速,由动能定理,可得:
 (3分)
(3分)
带电粒子在磁场中偏转,由牛顿第二定律,可得:
 (3分)
(3分)
由以上两式,可得  。 (1分)
。 (1分)
(3)带电粒子在两磁场区运动半径相同,如图14所示,三段圆弧的圆心组成的三角形ΔO1O2O3是等边三角形,其边长为2R。所以
在中间磁场中运动时间 (3分)
(3分)
在右侧磁场中运动时间 , (3分)
, (3分)
则粒子在磁场中回转一周所用时间为
 。
。
(1分)
25.(15分)
(1)双氧水(或过氧化氢)(1分),Na2O2(其它合理答案也可)(1分)
2Na2O2+2H2O=4NaOH+O2↑(3分)
(2)a(2分)
(3)①2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑+8H2O(2分)
②吸收多余氯气,防止污染空气。(2分)
Cl2+2OH―
Cl―+ClO―+H2O(2分)
(4)洗气瓶、安全瓶(其它合理答案也可)(各1分,共2分)
26.(16分)(1)O2- ……………(2分) O22-(或O2-、O3-)………………(2分)
(2)2OH―+2Al+2H2O=2AlO2―+3H2↑ ……………………………………(2分)
(3)Si ……………………………………………………………………………(2分)
(4)甲烷……………………(2分) H―O―H ………………………(2分)
(5)负……(2分) H2+2OH―-2e―==2H2O(其它合理答案均给分)……(2分)
27.(15分)
(1)氯化氢(2分);Ag++Cl-=AgCl↓(2分)
(2)①④ (2分)
(3)3mol/(L?min)(3分);10%(3分)
(4)NO+NO2+2NaOH=2NaNO2+H2O(3分)
28.Ⅰ(1)一;(2/)拇指能向背侧弯曲。(2/)
(2)第一组:AA X AA、AA X Aa、Aa X Aa;(2/)(3)aa ;Aa;aa。(2/)
Ⅱ(1)人工诱变(1/), 基因突变的频率(1/)
(2)电离辐射促使雄性不育(1/)。灭蝇效果好,不会造成环境污染。(2/)
(3)自然选择决定生物进化的方向;突变可以产生进化的原材料;生物进化的实质是基因频率的变化。(2/)(答出两点即得分)
29.(1)反馈(1/) 促甲状腺激素(1/) 核搪体、高尔基体、线粒体、内质网(只要合理即可)(2/)
(2)两(1/) (3)抗原(1/) T细胞(1/) 体液(1/)
(4)① 大小、年龄等生理状况基本相同的健康;(2/)随机均分成两组,并编号A、B(2/)
②等剂量的生理盐水(2/)
③向A、B两组小鼠体内注射等量的没有放射性的抗原X,观察A、B两组小鼠是否具有免疫力(4/)
④实验结果预测及结论①若A、B两组小鼠都对抗原X具有免疫力,说明效应淋巴细胞是在抗原刺激下由其他淋巴细胞转化形成的(2/)。②若A组小鼠对X不具有免疫力,而B组小鼠对X具有免疫力,说明效应细胞的产生是先天决定的(2/)。⑷ 对照(2/)。
30.物理选做题:
A.(物理--选修2-2)
(1)蒸发器 容易汽化,也容易液化(或物态容易变化) (4分)
(2)能。采用电磁换向阀来改变制冷剂的循环流向(若答出调换室内外热交换器的位置,也可以) (4分)
(3)根据ε= ,W=
,W= ,得出W=2×106J
(3分)
,得出W=2×106J
(3分)
根据热力学第一定律Q1=Q2+W (3分)
冰箱放出的热量为Q1=2.2×107J (1分)
B.(物理--选修3-3)
解:(1)此过程为等压变化过程
由 ………… 3分
………… 3分
V2=2V2 T1=273+27=300K
得T2=2T1=600K………… 2分
(2)此过程为等容变化过程,由查理定律得
 ………… 3分
………… 3分
P2=P0 T3=300K
|