
题目列表(包括答案和解析)
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:![]()
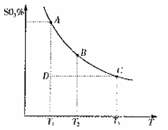
![]() 混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
 ①
①![]() 的△H 0(填“>”
的△H 0(填“>”
或“<”);若在恒温、恒压条件下向上述平衡体系中 通入氦气,平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,
则K1 K2;反应进行到状态D时,V正 v逆
(填“>”、“<”或“=)
 (2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
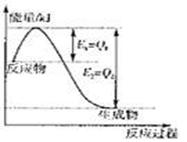
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: 。(△H的数值用含字母Q1、Q2的代数式表示)
②氨气溶于水得到氨水。在25°C下,将a mol·L-1的氨水与
b mol·L-1的盐酸等体积混合,反应后溶液中显中性,则:
c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示该混合溶液中一水合出氨的电离平衡常数表达式 。
(3)1000℃时,硫酸钠与氢气发生下列反应:
Na2SO4(s) + 4H2(g) ![]() Na2S(s) + 4H2O(g) 。
Na2S(s) + 4H2O(g) 。
①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性
(4)25℃时,已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为 。(填序号)
a..NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com