
题目列表(包括答案和解析)
硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
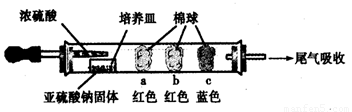
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白:

|
棉球 |
棉球上滴加的试剂 |
实验现象 |
解释和结论 |
|
a |
|
棉球变白,微热后又恢复红色 |
|
|
b |
含酚酞的NaOH溶液 |
棉球变为白色 |
离子方程式:
|
|
c |
|
棉球变为白色 |
结论:该气体具有 性 |
Ⅱ、硬质玻璃管与其它装置结合完成定性或定量实验。下图是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的装置。
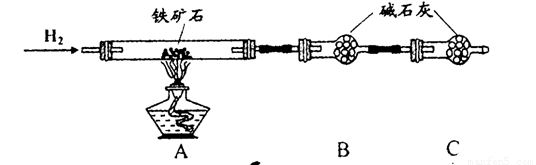
实验一:铁矿石中含氧量的测定
a.按上图组装仪器(夹持仪器均省略),检查装置的气密性;
b.将5.0g铁矿石放入硬质玻璃管中;
c.从左端导气管口处不断地缓缓通入H2, 后,点燃A处酒精灯;
d.充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)步骤c中填空
(2)测得反应后装置B增重1.35g,则铁矿石中氧的质量分数为______________________。实验二:铁矿石中含铁量的测定
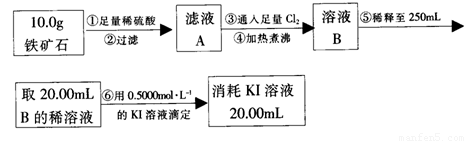
(3)步骤④中煮沸的目的是_____________________________________________。
(4)步骤②和⑤中都要用到的玻璃仪器是______ __。
(5)下列有关步骤⑥的操作中说法不正确的是_______________________________。
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶不需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成
(6)由实验一、二得出该铁矿石中铁的氧化物的化学式为____________________________。
(15分)硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白:
|
棉球 |
棉球上滴加的试剂 |
实验现象 |
解释和结论 |
|
a |
|
棉球变白,微热后又恢复红色 |
|
|
b |
含酚酞的NaOH溶液 |
棉球变为白色 |
离子方程式: |
|
c |
|
棉球变为白色 |
该气体具有 (选填“氧化性”或“还原性”) |
Ⅱ、硬质玻璃管与其它装置结合完成定性或定量实验。下图是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的装置。
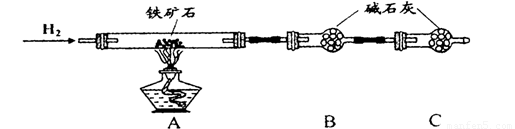
实验一:铁矿石中含氧量的测定
(1)按上图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H2, 后,点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为______________________。
实验二:铁矿石中含铁量的测定
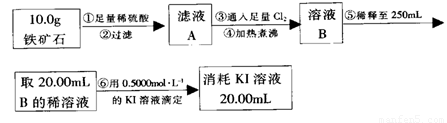
(1)步骤②和⑤中都要用到的玻璃仪器是 __。
(2)下列有关步骤⑥的操作中说法不正确的是_______。
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com