
题目列表(包括答案和解析)




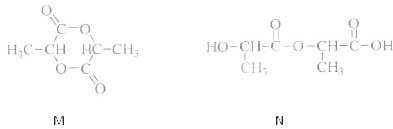

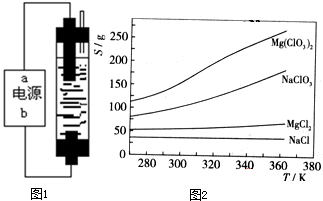
(1)请分析能用该装置制取、干燥、收集和吸收的气体对反应物、反应条件及气体性质必须符合的要求:
①对反应物的要求:______________________________________________________;
②对反应条件的要求:____________________________________________________;
③对生成气体性质的要求:_________________________________________________。
(2)用该装置制取氯气时,A中是高锰酸钾,B中是浓盐酸,反应后溶液中存在大量Mn2+。分别写出A中和NaOH溶液反应的离子方程式:
A中_________________________,NaOH溶液中______________________________。

图9-4
(1)请你分析用该装置制取、干燥、收集气体和尾气吸收气体必须符合的要求:
①对反应物的要求:_____________________________________________________;
②对反应条件的要求:_____________________________________________________;
③对生成气体性质的要求:__________________________________________________。
(2)若用该装置制取H2S时,A中是FeS2、B中是稀硫酸,反应后溶液中有淡黄色的混浊。则:
①图9-4所示装置应作出的变动有__________________________________;
②A中反应的离子方程式为__________________________________;
③NaOH溶液中反应的离子方程式为__________________________________。
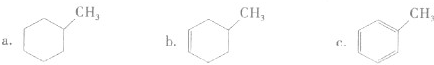
| ||
| ||
| ||
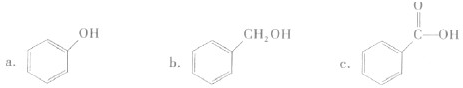
| ||
| ||
| ||
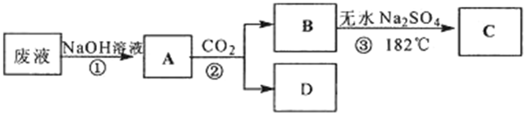
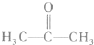
 +CO2+H2O→
+CO2+H2O→ +NaHCO3
+NaHCO3 +CO2+H2O→
+CO2+H2O→ +NaHCO3
+NaHCO3
|
2- 3 |
2- 6 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com