
题目列表(包括答案和解析)


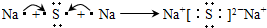
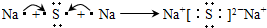
(14分)A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:
①反应 能放出大量的热,该反应曾应用于铁轨的焊接;
能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和 可以发生反应:2E+I
可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为_______________________________;
(2)化合物Ⅰ的电子式为______________________,
(3)1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量(写出化学方程式和计算结果); ,
(4)C与过量NaOH溶液反应的化学方程式为__________________,反应后溶液与过量化合物Ⅰ反应的化学方程式为_____________________________;
(5)E在I中燃烧可能观察到的现象是__________________________。
(14分)A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:

①反应 能放出大量的热,该反应曾应用于铁轨的焊接;
能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和 可以发生反应:2E+I
可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为_______________________________;
(2)化合物Ⅰ的电子式为______________________,
(3)1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量(写出化学方程式和计算结果); ,
(4)C与过量NaOH溶液反应的化学方程式为__________________,反应后溶液与过量化合物Ⅰ反应的化学方程式为_____________________________;
(5)E在I中燃烧可能观察到的现象是__________________________。
A、B、C、D、E、F、G、H是元素周期表中八种原子序数依次增大的短周期元素。[来源:ZXXK]
①A元素的原子半径在周期表中最小
②B元素的原子最外层电子数是次外层电子数的两倍
③C元素的最高价氧化物的水化物和氢化物反应生成盐
④D元素和E元素可以形成E2D、E2D2两种离子化合物
⑤G与D两种元素同主族,F、G、H三种元素同周期
⑥F元素是同周元素中离子半径最小的元素,H元素是同周期元素中原子半径最小的元素
(1)写出A、D、E三种元素形成的化合物的电子式 ;
(2)用惰性电极电解由E与H两元素形成的化合物的水溶液,其化学方程式为 ;
(3)八种元素中任意三种组成的易溶于水的酸性物质,能促进水电离的是 ,能抑制水电离的是 (各写一种化学式);
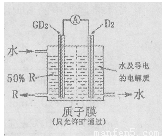
(4)某科研单位依据电化学原理用GD2来制备一种强酸R,装置如右图,电极为含有某种催化剂的多孔材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入GD2的电极为 极,其电极反应式为 ;
(5)甲、乙、丙分别是B、F、G三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应产物不同。回答问题:
①向甲溶液中缓慢滴加过量的丙溶液,可观察到的实验现象是 ;
②向乙溶液中缓慢滴加过量的丙溶液发生反应的离子方程式为 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com