(1)下列关于实验操作的叙述中正确的为
②⑤⑥⑦
②⑤⑥⑦
.(填序号)
①从试剂瓶中取出的任何药品,若有剩余,不能再放回原试剂瓶
②可燃性气体点燃之前必须先验纯
③用胶头滴管向试管中滴加液体时,一定要将滴管伸入试管中
④在中和滴定的实验过程中,目光应注视滴定管中液面的变化
⑤蒸馏时,应使温度计水银球与蒸馏烧瓶支管口在同一水平线上
⑥分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
⑦配制浓硫酸和浓硝酸的混酸时,应将浓硫酸慢慢加到浓硝酸中,并及时搅拌和冷却
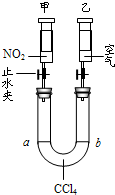
(2)在常温、常压下,注射器甲中装有NO
2气体,注射器乙中装有同体积的空气(如图所示,夹持仪器均已略去).
①常温下,打开两个止水夹后,同时向外拉动两注射器的活塞,且拉动的距离相同,将会看到U型管中液面a
下降
下降
(升高、下降、不变);
②如将注射器甲中的气体换成NH
3,U型管中的CCl
4换成水,仍在常温下,打开两个止水夹后,同时向里推动两注射器的活塞,且推动的距离相同,将会看到U型管中液面a
上升
上升
(升高、下降、不变).
(3)下列仪器和装置,经过简单连接,可制备中学化学常见的多种不同的气体(暂不考虑尾气的吸收).
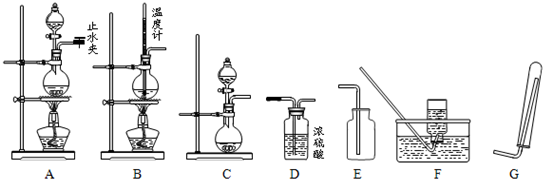
请回答下列问题:
(1)检验A装置气密性的操作为
关闭A装置的止水夹和分液漏斗的旋塞,向分液漏斗中加水.然后打开分液漏斗的旋塞,当少许水进入烧瓶后滴水停止,说明装置A不漏气
关闭A装置的止水夹和分液漏斗的旋塞,向分液漏斗中加水.然后打开分液漏斗的旋塞,当少许水进入烧瓶后滴水停止,说明装置A不漏气
.
(2)若用橡胶管连接了装置“B→F”,可制备的气体为
CH2=CH2
CH2=CH2
.
(3)若用橡胶管连接了装置“C→D→G”,可制备的气体为
H2
H2
.
(4)若用橡胶管连接了装置“C→D→E”,则实验室制备该气体时发生反应的离子方程式为
CaCO3+2H+=Ca2++CO2↑+H2O
CaCO3+2H+=Ca2++CO2↑+H2O
.

 (1)下列关于实验操作的叙述中正确的为
(1)下列关于实验操作的叙述中正确的为
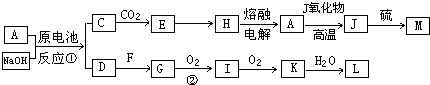
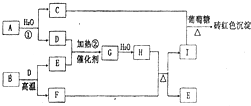 (2011?郑州二模)如图为物质A?I的转化关系(部分反应物、生成物没有列出).其中B为某金屑矿的主要成分,经过一系列反应可得到E和F.D、E常温下为气体,D、F为常见单质,
(2011?郑州二模)如图为物质A?I的转化关系(部分反应物、生成物没有列出).其中B为某金屑矿的主要成分,经过一系列反应可得到E和F.D、E常温下为气体,D、F为常见单质,
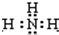
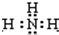
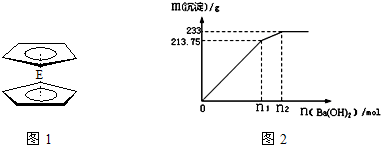
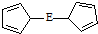 .核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有
.核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有