
题目列表(包括答案和解析)

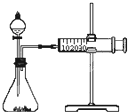 影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.药品:Cu、Fe、Na和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L);装置如图.
影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.药品:Cu、Fe、Na和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L);装置如图.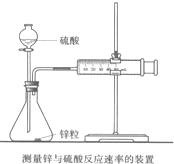 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中 ② 分别投入大小、形状相同的铜、铁、镁 分别投入大小、形状相同的铜、铁、镁 |
反应速率镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
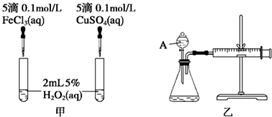
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg. |
反应快慢:Mg>Fe>Cu | 反应物的性质越活泼,反应速度越快 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com