
题目列表(包括答案和解析)
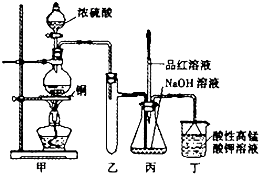
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:

请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,则H2SO4是否剩余________,原因是_________________________。
(2)向反应后的溶液中加入足量的CuO,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·xH2O)某小组同学采用加热法测定该晶体里结晶水x的值。
①冷却结晶后要获得较纯净的硫酸铜晶体采取的操作是____________________;
②加热法测定该晶体里结晶水x的值,结晶水完全失去的判断方法是_____________________;ks5u
③下面是三次实验数据的平均值
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7 g | 22.7 g | 18.6 g |
根据上表数据计算出x的实测值为________。
(3)装置乙的作用是_________________________________________________________。
(4)下列说法正确的是________(填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
(15分)
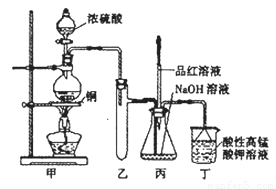
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如下图所示:
请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,则H2SO4 是否剩余 ,原因是
(2)向反应后的溶液中加入足量的CuO,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·XH2O)某小组同学采用加热法测定该晶体里结晶水X的值;
① 冷却结晶后要获得较纯净的硫酸铜晶体采取的操作是
②在他们的每一次实验操作中至少称量 次。
③加热法测定该晶体里结晶水X的值,结晶水完全失去的判断方法是 ;
④下面是三次实验数据的平均值
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
根据上表数据计算出x的实测值为
(3)装置乙的作用是: ;
(4)下列说法正确的是: (填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
(15分)
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如下图所示:
请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,则H2SO4 是否剩余 ,原因是
(2)向反应后的溶液中加入足量的CuO,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·XH2O)某小组同学采用加热法测定该晶体里结晶水X的值;
① 冷却结晶后要获得较纯净的硫酸铜晶体采取的操作是
②在他们的每一次实验操作中至少称量 次。
③加热法测定该晶体里结晶水X的值,结晶水完全失去的判断方法是 ;
④下面是三次实验数据的平均值
|
坩埚质量 |
坩埚与晶体总质量 |
加热后坩埚与固体总质量 |
|
11.7g |
22.7g |
18.6g |
根据上表数据计算出x的实测值为
(3)装置乙的作用是: ;
(4)下列说法正确的是: (填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com