(2008?江苏)将一定量的SO
2和含0.7mol氧气的空气(忽略CO
2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO
2+O
2 2SO
3(正反应放热).反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O
2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积).(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是
bc
bc
.(填字母)
a.SO
2和SO
3浓度相等 b.SO
2百分含量保持不变
c.容器中气体的压强不变 d.SO
3的生成速率与SO
2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO
2的转化率,下列措施可行的是
b
b
.(填字母)
a.向装置中再充入N
2 b.向装置中再充入O
2c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO
2的转化率(用百分数表示).
(4)若将平衡混合气体的5%通入过量的BaCl
2溶液,生成沉淀多少克?

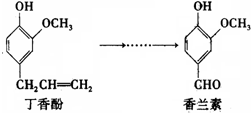 (2008?江苏)香兰素是重要的香料之一,它可由丁香酚经多步反应合成.有关上述两种化合物的说法正确的是( )
(2008?江苏)香兰素是重要的香料之一,它可由丁香酚经多步反应合成.有关上述两种化合物的说法正确的是( )