
题目列表(包括答案和解析)
(12分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH
(1)已知,该反应在300℃,5MPa条件下能自发进行,则ΔH 0,△S 0 (填“<,>或=”)。
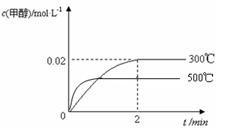
(2)在300℃,5MPa条件下,将0.20mol的 CO与0.58mol H2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。
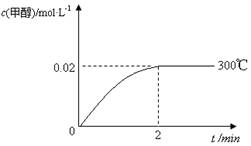
①在0~2min内,以H2表示的平均反应速率为 mol·L-1·s-1 。
②列式计算300℃时该反应的平衡常数K = 。
③300℃时,将0.50mol CO、1.00mol H2和1.00 mol CH3OH充入容积为2L的密闭容器中,此时反应将 。
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
④下列措施可增加甲醇产率的是
A.压缩容器体积 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.20mol CO和0.58mol H2
(3)若其它条件不变,使反应在500℃下进行,在图中作出甲醇的物质的量浓度随时间的变化的示意图。
【解析】(1)根据反应的特点可知△S小于0,因为反应在300℃,5MPa条件下能自发进行,所以根据△G=△H-T·△S可知反应是放热反应。
(2)①反应速率通常用单位时间内浓度的变化量来表示,根据图像可知反应进行到2min时甲醇
的浓度不再发生变化,平衡时甲醇的物质的量是0.04mol,则消耗氢气是0.08mol,所以在0~2min
内,以H2表示的平均反应速率为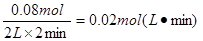 。
。
②平衡时氢气的浓度是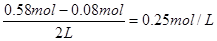 ,CO的平衡浓度是
,CO的平衡浓度是
 ,所以该温度下的平衡常数为
,所以该温度下的平衡常数为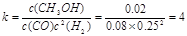 。
。
③300℃时,将0.50mol CO、1.00mol H2和1.00 mol
CH3OH充入容积为2L的密闭容器中,此时它们的浓度分别为0.25mol/L、0.50mol/L、、0.50mol/L,因为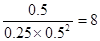 >4,所以反应向逆反应方向移动。
>4,所以反应向逆反应方向移动。
④压缩体积,压强增大,平衡向正反应方向移动。选项B是降低生成物浓度,平衡也向正反应方
向移动。充入He,使体系总压强增大,但物质但浓度没有变化,所以平衡不移动。再充入0.20mol
CO和0.58mol H2,相当于增大体系的压强,平衡向正反应方向移动,所以答案是ABD。
(3)因为反应是放热反应,所以升高温度平衡向逆反应方向移动,但反应速率会加快,所以图
像为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com