
题目列表(包括答案和解析)
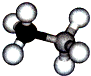 氨硼烷是一种有效、安全的固体储氢材料.氨硼烷的结构和乙烷相似,如图.
氨硼烷是一种有效、安全的固体储氢材料.氨硼烷的结构和乙烷相似,如图.Ⅰ.含氮化合物西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。已知其相关性质如下表所示:
|
分子式 |
结构简式 |
外观 |
熔点 |
溶解性 |
|
C12H10ClN3O |
|
白色结晶粉末 |
170~172℃ |
易溶于水 |
(1)氯吡苯脲的晶体类型为_______ ,所含第二周期元素第一电离能从大到小的顺序为
________________(用元素符号表示)。
(2)氯吡苯脲熔点低,易溶于水的原因分别为 _ 。
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲。
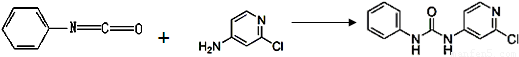
异氰酸苯酯 2-氯-4-氨基吡啶 氯吡苯脲
反应过程中,每生成1mol氯吡苯脲,断裂_______个σ键、断裂_______个π键。
(4)含氮的化合物氨气水溶液逐滴加入硝酸银溶液中制备银氨溶液,写出银氨溶液的配制过程中沉淀溶解的离子方程式 。
Ⅱ.下列是部分金属元素的电离能
|
|
X |
Y |
Z |
|
第一电离能(kJ/mol) |
520.2 |
495.8 |
418.8 |
(5)已知X、Y、Z的价层电子构型为ns1,则三种金属的氯化物(RCl)的熔点由低到高的顺序为:
。
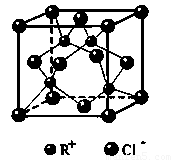
(6)RCl可用作有机合成催化剂, 并用于颜料, 防腐等工业。R+中所有电子正好充满K、L、M 三个电子层,它与Cl-形成的晶体结构如下图所示。元素R基态原子的电子排布式 _ ,
与同一个Cl-相连的 R+有 个。
某α-氨基酸,相对分子质量不超过200,经分析可知,该氨基酸含C,H,O,N四种元素,其中氮元素的质量分数为8.5%,氧元素的质量分数为19.4%.
(1)该氨基酸的分子中有________个 NH2,________个
NH2,________个 COOH.
COOH.
(2)该氨基酸的相对分子质量为(取整数值)________.
(3)若氨基酸分子结构中无甲基( CH3),有
CH3),有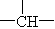 和苯环,写出其结构简式________.
和苯环,写出其结构简式________.
(4)另有一种有机A是上述氨基酸的同分异构体,A分子中也含有苯环,但不含 NH2和
NH2和 COOH,且苯环上的一卤代物只有一种,则A的结构简式可能为:________、________.
COOH,且苯环上的一卤代物只有一种,则A的结构简式可能为:________、________.
(12分)【化学——物质结构与性质】
氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是 。
| A.N2可用于填充霓虹灯。其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量 |
| B.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na |
| C.基态As原子中,电子占据的最高能级为4d |
| D.Bi原子中最外层有5个能量相同的电子 |
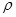 g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。
g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。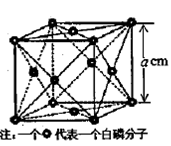
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com