(2012?建邺区一模)以下是甲、乙两同学对有关镁与盐酸反应的系列研究
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化
(1)实验时需将镁条进行打磨,其目的是
去除表面的氧化镁等杂质
去除表面的氧化镁等杂质
.
(2)反应中试管外壁发烫,说明镁与稀盐酸反应是
放热
放热
反应(填“吸热”或“放热”),化学方程式为
Mg+2HCl=MgCl2+H2↑
Mg+2HCl=MgCl2+H2↑

(3)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,则t
1~t
2时间内反应速率逐渐加快的主要原因是
镁与盐酸反应放热,温度越高反应速度越快
镁与盐酸反应放热,温度越高反应速度越快
.
研究二.反应后所得溶液的酸碱性探究
发现问题:
(1)反应后甲同学用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶液呈
酸
酸
性,(选填“酸”“碱”或“中”).
(2)反应后乙同学的试管中镁条有剩余,向试液中滴入两滴酚酞溶液,振荡显红色,说明乙同学所得溶液呈
碱
碱
性.对此现象,乙同学重复如上实验,得到同样结果.
提出猜想:
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7.
乙同学:猜想Ⅰ:氯化镁溶液使酚酞变红色; 猜想Ⅱ:镁与热水反应使酚酞变红色.
实验与思考:
为验证猜想,甲、乙两同学均需测定
氯化镁
氯化镁
溶液的酸碱性,实验表明该溶液显弱酸性.
乙同学为完成猜想Ⅱ,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,请根据实验现象写出镁与水反应的化学反应方程式
.
结论:
镁与稀盐酸反应,镁反应完全后所得溶液显酸性;
镁与稀盐酸反应,镁过量时所得溶液显碱性.
拓展与延伸:
(1)金属氯化物的水溶液可能显中性或弱酸性;与金属的活动性顺序有关,如氯化钠溶液显中性,氯化镁溶液显弱酸性,氯化钾溶液显
中
中
性.
(2)活泼金属能与水在一定条件下反应.实验发现钠与冷水剧烈反应,产生大量的气体.由此可见金属与水反应与金属的活动性顺序
有关
有关
(填“有关”或“无关”).
研究三.金属活动性强弱与原子结构的关系
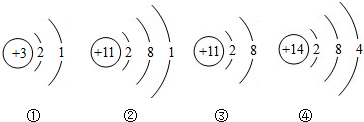
如图为镁原子、钙原子和钡离子结构示意图,据此推测,这三种金属的活动性最强的是
Ba
Ba
.


 (1)下列化学用语中数字“2”表示分子个数的是
(1)下列化学用语中数字“2”表示分子个数的是