
题目列表(包括答案和解析)
|
下列反应中盐酸作还原剂的是 | |
A. |
MnO2+4HCl(浓) |
B. |
CaCO3+2HCl |
C. |
2HCl+Zn |
D. |
2KMnO4+16HCl |
|
下列反应中盐酸作还原剂的是 | |
| [ ] | |
A. |
NaOH+HCl |
B. |
Zn+2HCl |
C. |
MnO2+4HCl(浓) |
D. |
CuO+2HCl |
|
下列属于氧化还原反应且盐酸作为氧化剂的是 | |
| [ ] | |
A. |
Zn+2HCl |
B. |
CaCO3+2HCl |
C. |
MnO2+4HCl(浓) |
D. |
Ca(ClO)2+2HCl |
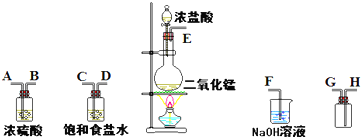
| ||
| ||
 MnCl2+Cl2↑+2H2O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
MnCl2+Cl2↑+2H2O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com