
题目列表(包括答案和解析)
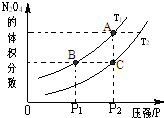 研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:| c(H2)?c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(9分)已知在酸性条件下有以下反应关系:
①KBrO3能将KI氧化成I2或KlO3,其本身被还原为Br2
2BrO3-+10I-+12H+===5I2+Br2+6H2O 6BrO3-+5I-+6H+===5IO3-+3Br2+3H2O
②Br2能将I-氧化为I2
Br2+2I-===2Br-+I2
③KIO3能将I-氧化为I2,也能将Br-氧化成Br2,其本身被还原为I2
IO3-+5I-+6H+===3I2+3H2O 2IO3-+10Br-+12H+===I2+5Br2+6H2O
(1)在上述反应涉及的粒子中氧化性最强的是________。
(2)在KI和KBr的混合溶液中,加入过量的KBrO3,其氧化产物为________,还原产物为________。
(3)向含有1 mol KI的硫酸溶液中加入KBrO3溶液,反应后碘元素只存在于I2中,溴元素只存在于Br-中,则加入KBrO3的物质的量为________。
(4)将6 mL 0.4 mol·L-1 KBrO3溶液和10 mL 0.4 mol·L-1KI溶液在稀H2SO4中混合。写出发生反应的离子方程式______________________________________________________。
(4)10I-+6BrO3-+12H+===3Br2+3I2+4IO3-+6H2O
混合物由金属M的盐酸盐和其氧化合,以及另一种金 属N的氧化物组成。有以下反应关系:

据此判断:
(1)沉淀D的化学式为___________________________________。
(2)反应③的化学方程式为________________________________。
(3)反应①②④的离子方程式为
①__________________________________________________,②___________________________________,④____________________________________。
(9分)已知在酸性条件下有以下反应关系:
①KBrO3能将KI氧化成I2或KlO3,其本身被还原为Br2
2BrO3-+10I-+12H+===5I2+Br2+6H2O 6BrO3-+5I-+6H+===5IO3-+3Br2+3H2O
②Br2能将I-氧化为I2
Br2+2I-===2Br-+I2
③KIO3能将I-氧化为I2,也能将Br-氧化成Br2,其本身被还原为I2
IO3-+5I-+6H+===3I2+3H2O 2IO3-+10Br-+12H+===I2+5Br2+6H2O
(1)在上述反应涉及的粒子中氧化性最强的是________。
(2)在KI和KBr的混合溶液中,加入过量的KBrO3,其氧化产物为________,还原产物为________。
(3)向含有1 mol KI的硫酸溶液中加入KBrO3溶液,反应后碘元素只存在于I2中,溴元素只存在于Br-中,则加入KBrO3的物质的量为________。
(4)将6 mL 0.4 mol·L-1 KBrO3溶液和10 mL 0.4 mol·L-1KI溶液在稀H2SO4中混合。写出发生反应的离子方程式______________________________________________________。
(4)10I-+6BrO3-+12H+===3Br2+3I2+4IO3-+6H2O
(9分)已知在酸性条件下有以下反应关系:
①KBrO3能将KI氧化成I2或KlO3,其本身被还原为Br2
2BrO3-+10I-+12H+===5I2+Br2+6H2O 6BrO3-+5I-+6H+===5IO3-+3Br2+3H2O
②Br2能将I-氧化为I2
Br2+2I-===2Br-+I2
③KIO3能将I-氧化为I2,也能将Br-氧化成Br2,其本身被还原为I2
IO3-+5I-+6H+===3I2+3H2O 2IO3-+10Br-+12H+===I2+5Br2+6H2O
(1)在上述反应涉及的粒子中氧化性最强的是________。
(2)在KI和KBr的混合溶液中,加入过量的KBrO3,其氧化产物为________,还原产物为________。
(3)向含有1mol KI的硫酸溶液中加入KBrO3溶液,反应后碘元素只存在于I2中,溴元素只存在于Br-中,则加入KBrO3的物质的量为________。
(4)将6mL 0.4 mol·L-1 KBrO3溶液和10 mL 0.4 mol·L-1KI溶液在稀H2SO4中混合。写出发生反应的离子方程式______________________________________________________。
(4)10I-+6BrO3-+12H+===3Br2+3I2+4IO3-+6H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com