(2013?烟台模拟)硫、氮、碘都是重要的非金属元素.
(1)某一反应体系中有反应物和生成物共5种物质:S、H
2S、HNO
3、NO、H
2O.该反应中还原剂是
H2S
H2S
.若反应过程中转移了0.3mol电子,则反应的HNO
3的质量是
6.3
6.3
g.
(2)已知:2I(g)═I
2(g)△H=-151 kJ?mol
-1;2H(g)═H
2(g)△H=-436 kJ?mol
-1;HI(g)=H(g)+I(g)△H=+298 kJ?mol
-1.相同条件下,H
2与I
2反应生成HI的热化学方程式为:H
2(g)+I
2(g)=2HI(g)△H=
-9
-9
kJ?mol
-1.
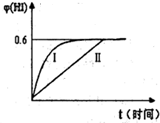
(3)将1molI
2(g)和2molH
2(g)置于某2L密闭容器中,在一定温度下发生反应:H
2(g)+I
2(g)?2HI(g)并达平衡.HI的体积分数φ(HI)随时间变化如图曲线II所示:
①达到平衡时,I
2(g)的物质的量浓度为
0.05
0.05
mol?L
-1.
②保持加入的反应物的物质的量不变,若改变反应条
件,在某一条件下φ(HI)的变化如曲线I所示,则该条件可能是
AB
AB
(填编号),在这种条件下平衡常数K值
不变
不变
(填“增大”、“变小”或“不变’,).
A.恒温条件下,缩小反应的容积 B.恒容条件下.加入适当催化剂
C.在恒容下,升高温度 D.在恒容下,充入N
2使容器压强增大
③若保持温度不变,在另一相同的2L密闭容器中加入1mol H
2(g)和2mol Hl(g),发生反应达到平衡时,H
2的体积分数为
37%
37%
.