
题目列表(包括答案和解析)
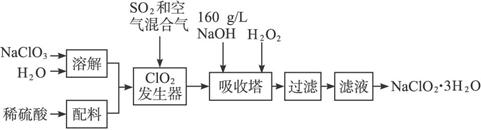
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③
(1)
(2)发生器中鼓入空气的作用可能是_____________(选填序号)。
a.将SO2氧化成SO3,增强酸性
b.稀释ClO2以防止爆炸
c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为____________。吸收塔的温度不能超过
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是________________________。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是____________(选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(6)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是____________(选填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2·3H2O晶体必须进行的操作是____________(填操作名称)。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2![]() 3H2O。
3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③HClO2可看成是强酸。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个量是 (用文字说明)。
(2)发生器中鼓入二氧化硫的作用可能是 (填序号)。
A.将SO2氧化成SO3,增强酸性 B.稀释ClO2以防止爆炸;
C.将NaClO3还原成ClO2
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(4)吸收塔内的反应的化学方程式为 。吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式: 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (填序号)。
A.Na2S B.Na2O2 C.FeCl2
(6)从滤液中得到NaClO2![]() 3H2O粗晶体的实验操作依次是 (填序号)。
3H2O粗晶体的实验操作依次是 (填序号)。
A.蒸发 B.蒸馏 C.冷却结晶 D.灼烧 E.过滤
要得到更纯的NaClO2![]() 3H2O晶体能否加热蒸干 (填“能”或“不能”)。
3H2O晶体能否加热蒸干 (填“能”或“不能”)。
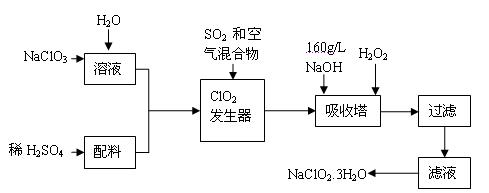
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2![]() 3H2O。
3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③HClO2可看成是强酸。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个量是 (用文字说明)。
(2)发生器中鼓入二氧化硫的作用可能是 (填序号)。
A.将SO2氧化成SO3,增强酸性 B.稀释ClO2以防止爆炸;
C.将NaClO3还原成ClO2
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(4)吸收塔内的反应的化学方程式为 。吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式: 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (填序号)。
A.Na2S B.Na2O2 C.FeCl2
(6)从滤液中得到NaClO2![]() 3H2O粗晶体的实验操作依次是 (填序号)。
3H2O粗晶体的实验操作依次是 (填序号)。
A.蒸发 B.蒸馏 C.冷却结晶 D.灼烧 E.过滤
要得到更纯的NaClO2![]() 3H2O晶体能否加热蒸干 (填“能”或“不能”)。
3H2O晶体能否加热蒸干 (填“能”或“不能”)。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
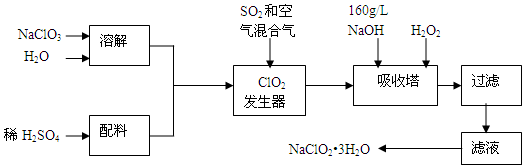
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 g NaOH固体溶于水所得溶液的体积为1L。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性; b.稀释ClO2以防止爆炸;
c.将NaClO3氧化成ClO2
(3)吸收塔内反应的离子方程式为 。
吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸馏 b.蒸发浓缩 c.灼烧 d.过滤洗涤 e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称)。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
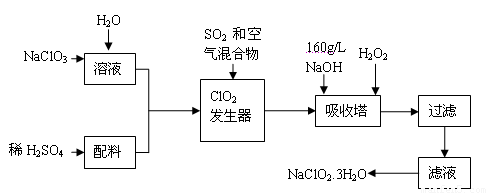
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2 3H2O。
3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③HClO2可看成是强酸。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个量是 (用文字说明)。
(2)发生器中鼓入二氧化硫的作用可能是 (填序号)。
A.将SO2氧化成SO3,增强酸性 B.稀释ClO2以防止爆炸;
C.将NaClO3还原成ClO2
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(4)吸收塔内的反应的化学方程式为 。吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式: 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (填序号)。
A.Na2S B.Na2O2 C.FeCl2
(6)从滤液中得到NaClO2 3H2O粗晶体的实验操作依次是 (填序号)。
3H2O粗晶体的实验操作依次是 (填序号)。
A.蒸发 B.蒸馏 C.冷却结晶 D.灼烧 E.过滤
要得到更纯的NaClO2 3H2O晶体能否加热蒸干 (填“能”或“不能”)。
3H2O晶体能否加热蒸干 (填“能”或“不能”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com