
题目列表(包括答案和解析)

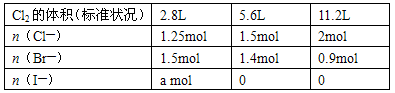
2- 4 |
(1)提出假设:A是FeCl3,B是FeCl2。
(2)设计实验方案:分别取A、B的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。
实验方法 | 实验现象 | 结论 |
分别向A、B溶液中加KSCN溶液 | ________ | 固体物质中有FeCl3 |
分别向KMnO4溶液中加适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含_______ |
(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式:___________________。
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是____________________________________________________________________。
A.将A溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔现象
B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到FeCl3固体
(5)实际应用:
FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有FeCl3、FeCl2、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收Cu的方案:
方案1:向废液中加入过量的铁粉,充分反应后,过滤。在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得到铜。方案1中涉及的四种阳离子的氧化性由强到弱的顺序为:_______________。
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出。方案2中铜作 极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)_____________。
方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:________________。
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | 溶液变红色 溶液变红色 |
固体物质中FeCl3 |
| 分别向KMnO4溶液中加入适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 FeCl2 FeCl2 |
| ||
| ||
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | ______ | 固体物质中FeCl3 |
| 分别向KMnO4溶液中加入适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含______ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com