
题目列表(包括答案和解析)
加入0.1 mol MnO2粉末于50 mL过氧化氢溶液(ρ=1.1 g·mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。
(1)反应放出![]() 气体所需时间为_____________
气体所需时间为_____________
(2)A、B、C、D各点反应速率快慢的顺序为_____________
(3)计算H2O2的初始物质的量浓度_____________
(4)求反应到2 min时,H2O2的质量分数_____________


图2-7
(1)实验时放出气体的总体积为_________________。
(2)放出一半气体所需要的时间为_________________。
(3)反应放出3/4气体所需要的时间为_________________。
(4)A、B、C、D四点化学反应速率快慢的顺序为_________________。
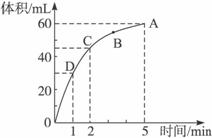
(1)实验时放出气体的总体积为______________。
(2)放出一半气体所需要的时间为______________。
(3)反应放出3/4气体所需要的时间为______________。
(4)A、B、C、D四点化学反应速率由快到慢的顺序为______________。
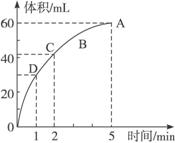
图2-7
(1)实验时放出气体的总体积为_________________。
(2)放出一半气体所需要的时间为_________________。
(3)反应放出3/4气体所需要的时间为_________________。
(4)A、B、C、D四点化学反应速率快慢的顺序为_________________。
加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g·mL-1),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题。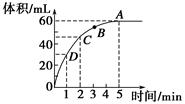
(1)A、B、C、D四点化学反应速率快慢的顺序为____________________。
(2)解释反应速率变化的原因__________________________________。
(3)计算过氧化氢的初始物质的量浓度________。
(4)求反应进行到2分钟时过氧化氢的质量分数。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com