
题目列表(包括答案和解析)
(14分)
(1)某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)=2NO2(g) △H1=+68kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(l) △H2=-534kJ/mol
请写出该次发射火箭时燃烧反应的热化学方程式 。
(2)下表是不同温度下水的离子积数据:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
 5Ca2+(aq)+3PO(aq)+OH-(aq);Ksp=2.5×10-59。进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。
5Ca2+(aq)+3PO(aq)+OH-(aq);Ksp=2.5×10-59。进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。 N2O4(g)的平衡常数K= 。若NO2起始浓度为2 mol/L ,相同条件下,NO2的最大转化率为 。
N2O4(g)的平衡常数K= 。若NO2起始浓度为2 mol/L ,相同条件下,NO2的最大转化率为 。|
LiAlH4 | |
| [ ] | |
A. |
LiH与D2O反应,所得氢气的摩尔质量为4 g/mol |
B. |
1 mol LiAlH4在125℃完全分解,转移3 mol电子 |
C. |
LiAlH4溶于适量水得无色溶液, 则化学方程式可表示为:LiAlH4+2H2O=LiAlO2+4H2↑ |
D. |
LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 |
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2![]() 2NH3 △H<0。反应过程中H2、N2和NH3物质的量变化如右图所示,据图判断下列叙述不正确的是
2NH3 △H<0。反应过程中H2、N2和NH3物质的量变化如右图所示,据图判断下列叙述不正确的是
A.反应开始到第一次平衡时,N2的平均反应速率为0.0625 mol·(L·min)-1,H2的转化率为75%
B.反应达到第一次平衡时,反应的平衡常数表达式可写作:K=c2(NH3)/[ c3(H2) ·c(N2)]=(0.15 mol·L-1) 2/[ (0.075 mol·L-1) 3 ·(0.125 mol·L-1)]
C.从曲线变化可以看出,反应进行到10min至20min时可能采取的措施是使用了催化剂。
D.从曲线变化可以看出,反应进行至25min时,采取的措施是分离出0.1mol的氨气,平衡正向移动。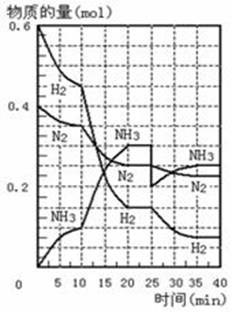
|
将1 mol A(g)和2 mol B(g)置于2 L某密闭容器中,在一定温度下发生反应:A(g)+2B(g)
| |
| [ ] | |
A. |
此反应过程中的能量变化可用上图Ⅱ表示 |
B. |
此温度下,该反应的平衡常数的值为1 |
C. |
该反应4 s内平均速率v(A)=0.125 mol·L-1·s-1 |
D. |
若在恒温加大反应容器的容积条件下,该反应将按b曲线进行 |
|
N2O5是一种新型硝化剂,在一定温度下可发生下列反应: 2N2O5(g) T1温度下的部分实验数据为:
下列说法不正确的是 | |
| [ ] | |
A. |
500 s内N2O5分解速率为2.96×10-3 mol/(L·s) |
B. |
T1温度下的平衡常数为K1=125(mol/L)3,1000 s时转化率为50% |
C. |
其他条件不变时,T2温度下反应到1000 s时测得N2O5(g)浓度为2.98 mol/L, 则T1<T2 |
D. |
T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com