
题目列表(包括答案和解析)
(15分)根据下图转化回答有关问题:
(1)① 写出AC反应生成乙酸乙酯的化学方程式_______________;
反应类型_______________;
② B的结构简式为_______________。
(2)某同学在实验室用如图所示的装置来制取乙酸乙酯。请回答下列问题:
① 浓硫酸的作用是_______________ _______________。
② 饱和碳酸钠溶液的主要作用_______________。
③ 装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的_______________ ,长导管的作用是_______________。
④ 若要把制得的乙酸乙酯分离出来,应采用的实验操作是_______________。
⑤ 进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是_______________。
⑥ 生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述不能说明该反应已达到化学平衡状态的是(填序号) _______________ 。
A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D.正反应的速率与逆反应的速率相等
E.混合物中各物质的浓度不再变化
(11分)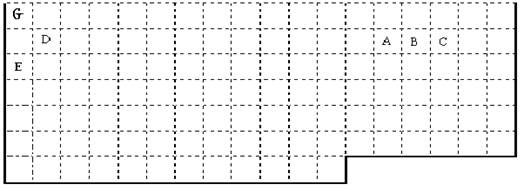
根据信息回答下列问题:
(1) 上表中实线是元素周期表的部分边界,请你用实线标出表的上边界,并把符合下列要求的元素的元素符号标在表中对应位置处。
① 最高价氧化物的水化物碱性最强(放射性元素除外)。
② 电负性最大。
③ 第一电离能对大。
(2)F元素的原子核外有25个运动状态不同的电子,F元素是 (名称),F2+的未成对电子数是_____ ,与F之具有相同最高正价的另一同周期元素的单质在常温下的状态为 。(填固态、液态、气态)
(3)列举一种由A、C、E、G四种元素组成的盐 。
(4)D的最高价氧化物对应的水化物属两性化合物,证明这一结论的有关离子方程式为_______________________________、_____________________________
(5)元素M基态原子中次外层有5个未成对电子而最外层只有一个电子; MCl3能与B和C的氢化物共同形成配位数为6的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。MCl3形成的配合物的化学式为_____ ___(用具体元素符号表示)。
(15分)根据下图转化回答有关问题: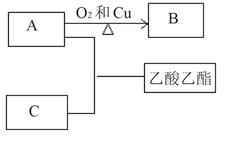
(1)①写出AC反应生成乙酸乙酯的化学方程式_______________;
反应类型_______________;
②B的结构简式为_______________。
(2)某同学在实验室用如图所示的装置来制取乙酸乙酯。请回答下列问题:
①浓硫酸的作用是_______________ _______________。
②饱和碳酸钠溶液的主要作用_______________。
③装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的_______________ ,长导管的作用是_______________。
④若要把制得的乙酸乙酯分离出来,应采用的实验操作是_______________。
⑤进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是_______________。
⑥生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述不能说明该反应已达到化学平衡状态的是(填序号) _______________ 。
| A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水 |
| B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸 |
| C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸 |
| D.正反应的速率与逆反应的速率相等 |
(11分)

根据信息回答下列问题:
(1) 上表中实线是元素周期表的部分边界,请你用实线标出表的上边界,并把符合下列要求的元素的元素符号标在表中对应位置处。
① 最高价氧化物的水化物碱性最强(放射性元素除外)。
② 电负性最大。
③ 第一电离能对大。
(2)F元素的原子核外有25个运动状态不同的电子,F元素是 (名称),F2+的未成对电子数是_____ ,与F之具有相同最高正价的另一同周期元素的单质在常温下的状态为 。(填固态、液态、气态)
(3)列举一种由A、C、E、G四种元素组成的盐 。
(4)D的最高价氧化物对应的水化物属两性化合物,证明这一结论的有关离子方程式为_______________________________、_____________________________
(5)元素M基态原子中次外层有5个未成对电子而最外层只有一个电子; MCl3能与B和C的氢化物共同形成配位数为6的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。MCl3形成的配合物的化学式为_____ ___(用具体元素符号表示)。
(15分)根据下图转化回答有关问题:
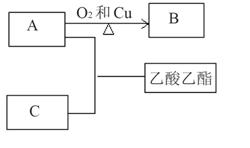
(1)① 写出AC反应生成乙酸乙酯的化学方程式_______________;
反应类型_______________;
② B的结构简式为_______________。
(2)某同学在实验室用如图所示的装置来制取乙酸乙酯。请回答下列问题:
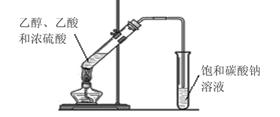
① 浓硫酸的作用是_______________ _______________。
② 饱和碳酸钠溶液的主要作用_______________。
③ 装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的_______________ ,长导管的作用是_______________。
④ 若要把制得的乙酸乙酯分离出来,应采用的实验操作是_______________。
⑤ 进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是_______________。
⑥ 生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述不能说明该反应已达到化学平衡状态的是(填序号) _______________ 。
A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D.正反应的速率与逆反应的速率相等
E.混合物中各物质的浓度不再变化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com