
题目列表(包括答案和解析)
正常情况下,人体胃液的pH在1.2~3.0之间。当人体内胃酸分泌过多时,会出现吐酸水、恶心、胃痛等症状。你若到医院去诊治,医生可能会建议你服用一些抗酸药品。
(1)从化学视角来分析,你认为以下物质中哪些可制作成为治疗“胃酸过多症”的药物( )
A.小苏打 B.胃舒平(内含氢氧化铝)
C.生石灰 D.低浓度的烧碱溶液
(2)经胃镜检查发现胃有少量出血,说明胃溃疡已深及胃黏膜下层,对于这样的胃酸过多症病人来说,可作为治疗“胃酸过多症”的药物是( )
A.小苏打 B.胃舒平(主要成分氢氧化铝)
C.生石灰 D.胃得乐(主要成分碳酸镁)
请你写出相关反应的离子方程式:_______________________________
(3)对于胃酸过多的胃溃疡病人来说,除了消除过多胃酸以外,还要同时服用消炎药物,阿莫西林就是其中一种。阿莫西林的结构简式如图所示:
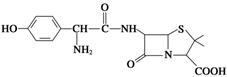
①请写出阿莫西林的化学式:____________________________________________;
②有关阿莫西林性质的说法错误的是( )
A.不能溶于水,能溶于乙醇,所以阿莫西林要与烧酒一起服用
B.既能与NaOH反应又能与盐酸反应
C.与氢气在一定条件下能发生加成反应
理论上任何自发的氧化还原反应都可以设计成原电池。如使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池。
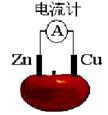
(1)现有如下材料设计类似的水果电池,并使电流计发生明显偏转。(不考虑空气参与)
酸性水果:柠檬、柑橘、橙子等
碱性水果:柿子、葡萄等
电极:A.镁条、B.铝片、C.铜片、D.碳棒。
①若选择酸性水果组装水果电池,负极材料可以是: (填所有可能的电极选项编号)
正极反应式为:
②若选择碱性水果组装水果电池,正极材料可以是: (填所有可能的电极选项编号)
(2)原电池的电解质溶液也可以呈中性,例如为海洋中的航行灯提供电能的就是由铝、空气、海水构成的原电池,该电池总反应为4Al+3O2+6H2O=4Al(OH)3,写出该电池的正极反应式 。
(3)电子表和电子计算器中所用的是纽扣式微型银锌电池,其电极分别为Ag2O和Zn,电解质为KOH溶液,工作时电池总反应为Ag2O+Zn +H2O = 2Ag+Zn(OH)2。工作时电池正极区的pH____________(填“增大”、“减小”或“不变”);当外电路中通过1.8 NA个电子,理论上消耗的锌的质量___________克。
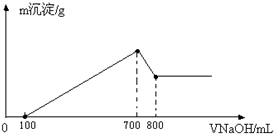 将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/L NaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示.求:
将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/L NaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示.求:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com