
题目列表(包括答案和解析)
正极材料为![]() 的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1)橄榄石型![]() 是一种潜在的锂离子电池正极材料,它可以通过
是一种潜在的锂离子电池正极材料,它可以通过![]() 、
、![]() 与
与![]() 溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应投料时,不将![]() 和
和![]() 溶液直接混合的原因是 。
溶液直接混合的原因是 。
②共沉淀反应的化学方程式为 。
③高温成型前,常向![]() 中加入少量活性炭黑,其作用除了可以改善成型后的
中加入少量活性炭黑,其作用除了可以改善成型后的![]() 的导电性能外,还能 。
的导电性能外,还能 。
(2)废旧锂离子电池的正极材料试样(主要含有![]() 及少量AI、Fe等)可通过下列实验方法回收钴、锂。
及少量AI、Fe等)可通过下列实验方法回收钴、锂。

在上述溶解过程中,![]() 被氧化成
被氧化成![]() ,
,![]() 在溶解过程中反应的化学方程式为 。
在溶解过程中反应的化学方程式为 。
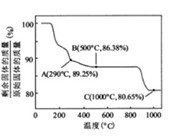
![]() 在空气中加热时,固体残留率随温度的变化,如下图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为 。(填化学式);在350~400℃范围内,剩余固体的成分为 。(填化学式)。
在空气中加热时,固体残留率随温度的变化,如下图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为 。(填化学式);在350~400℃范围内,剩余固体的成分为 。(填化学式)。
(12分)
钠米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4。
II.将SiCl4分离,得到纯净的TiCl4。
III.在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
IV.TiO2·Xh2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是 。II中所采取的操作名称是 。
②III中反应的化学方程式是 。
③如IV在实验室完成,应将TiO2·xH2O放在 (填仪器编号)中加热。
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O,其过程大致如下:
a. O2→2O b. O2+H2O→2OH(羟基) c. OH+OH→H2O2
①b中破坏的是 (填“极性共价键”或“非极性共价键”)。
②H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
(3)某研究小组用下列装置模拟“生态马路”部分原理。(夹持装置已略去)
①如缓通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重11g,则CO的转化率为 。
②当CO气体全部通入后,还要通一会儿空气,其目的是 。
正极材料为![]() 的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1)橄榄石型![]() 是一种潜在的锂离子电池正极材料,它可以通过
是一种潜在的锂离子电池正极材料,它可以通过![]() 、
、![]() 与
与![]() 溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应投料时,不将![]() 和
和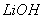 溶液直接混合的原因是 。
溶液直接混合的原因是 。
②共沉淀反应的化学方程式为 。
③高温成型前,常向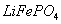 中加入少量活性炭黑,其作用除了可以改善成型后的
中加入少量活性炭黑,其作用除了可以改善成型后的![]() 的导电性能外,还能 。
的导电性能外,还能 。
(2)废旧锂离子电池的正极材料试样(主要含有![]() 及少量AI、Fe等)可通过下列实验方法回收钴、锂。
及少量AI、Fe等)可通过下列实验方法回收钴、锂。
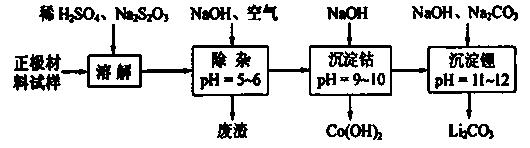
① 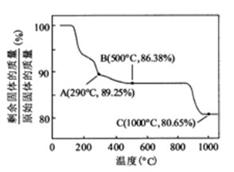 在上述溶解过程中,
在上述溶解过程中,![]() 被氧化成
被氧化成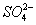 ,
,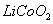 在溶解过程中反应的化学方程式为 。
在溶解过程中反应的化学方程式为 。
② ![]() 在空气中加热时,固体残留率随温度的变化
在空气中加热时,固体残留率随温度的变化
如右图所示。已知钴的氢氧化物加热至290℃时已完全
脱水,则1000℃时,剩余固体的成分为 。(填化学式);
在350~400℃范围内,剩余固体的成分为 。(填化学式)。
(12分)
钠米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4。
II.将SiCl4分离,得到纯净的TiCl4。
III.在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
IV.TiO2·Xh2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是 。II中所采取的操作名称是 。
②III中反应的化学方程式是 。
③如IV在实验室完成,应将TiO2·xH2O放在 (填仪器编号)中加热。
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O,其过程大致如下:
a. O2→2O b. O2+H2O→2OH(羟基) c. OH+OH→H2O2
①b中破坏的是 (填“极性共价键”或“非极性共价键”)。
②H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
(3)某研究小组用下列装置模拟“生态马路”部分原理。(夹持装置已略去)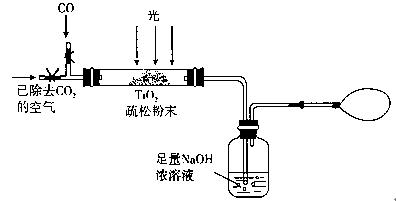
①如缓通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重11g,则CO的转化率为 。
②当CO气体全部通入后,还要通一会儿空气,其目的是 。
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备方法是:
Ⅰ.将干燥后的金红石(主要成分是TiO2,主要杂质是SiO2)与碳粉混合放入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
Ⅱ.将SiCI4分离,得到纯净的TiCl4。
Ⅲ.在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
Ⅳ.TiO2·xH2O高温分解得到TiO2。
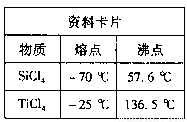
①根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是 ,分离二者所采用的操作名称是 。
②Ⅲ中反应的化学方程式是 。
③如Ⅳ在实验室中完成,应将TiO2·xH2O放在 (填字母)中加热。

(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2。H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
(3)某研究小组用下列装置模拟“生态马路”的部分原理。(夹持装置已略去)
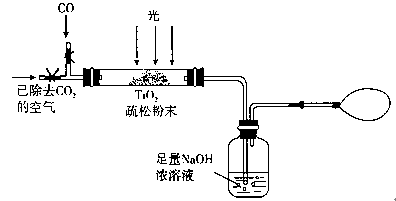
①如缓慢通入22.4 L(已折算成标准状况)CO气体,结果NaOH溶液增重11 g,则CO的转化率为 。
②当CO气体全部通入后,还要按图示通一段时间空气,其目的是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com