
题目列表(包括答案和解析)

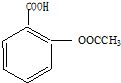
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |

某研究性学习小组设计用如下方法测定某居室空气中甲醛的含量(假设空气中无其他还原性气体):
Ⅰ.测定原理:KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸,其反应的离子方程式为:
4![]() +5HCHO+12H+====4Mn2++5CO2↑+11H2O
+5HCHO+12H+====4Mn2++5CO2↑+11H2O
2![]() +5H2C2O4+6H+====2Mn2++10CO2↑+8H2O
+5H2C2O4+6H+====2Mn2++10CO2↑+8H2O
Ⅱ.测定装置:部分装置如下图所示(a、b为止水夹)
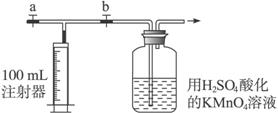
Ⅲ.实验步骤:
①检查装置气密性(气密性良好)。
②用A仪器准确移取25.00 mL 1.00×10-3 mol·L-1的高锰酸钾溶液(过量)于广口瓶中并滴入3滴6 mol·L-1 H2SO4溶液备用。
③将2.00×10-3 mol·L-1的草酸标准溶液置于A仪器中备用。
④打开a,关闭b,用注射器抽取100 mL新装修的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入高锰酸钾酸性溶液中,使其充分反应。再如此重复4次(共5次)。
⑤将广口瓶中的溶液转入锥形瓶中(润洗广口瓶2—3次,并将洗涤液全部转入锥形瓶)。
⑥用标准草酸溶液滴定锥形瓶中的溶液,记录滴定所消耗的草酸溶液体积。
⑦再重复实验2次。
Ⅳ.数据处理:分别于装修完工后的第1天、第7天、第30天(室内始终保持通风换气状况)对室内空气进行取样,通过实验测得以下三组数据(每次实验所取的KMnO4溶液均为25.00 mL):
装修后第n天 | 草酸溶液/mL | 甲醛的浓度/mg·m-3 | |||
1 | 2 | 3 | 平均值 | ||
1 | 15.86 | 15.72 | 15.67 | 15.75 |
|
7 | 26.24 | 26.36 | 26.31 | 26.30 |
|
30 | 30.90 | 30.67 | 30.81 | 30.79 |
|
请完成下列问题:
(1)A仪器名称是_________________ 。
(2)步骤④如果压送气体时速度过快,可能会产生什么不利后果?
_____________________________________________________________________。
(3)步骤⑤如果没有润洗,所测甲醛的含量将____________(填“偏高”“偏低”或“无影响”)。
(4)本实验是否需要指示剂(如果需要,请写出指示剂的名称;如果不需要,试说明终点时的实验现象):___________________________________________________________________。
(5)假设KMnO4溶液的物质的量浓度为c1 mol·L-1,所取KMnO4溶液的体积为V1 mL;草酸溶液的物质的量浓度为c2 mol·L-1,消耗草酸溶液的平均体积为V2 mL。
则:计算室内空气中甲醛浓度(mg·m-3)的代数式为____________,第30天室内空气中甲醛浓度为____________,并判断此时主人____________(填“能”或“否”)入住。
常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确定的致癌物和致畸形物之一。我国规定:居室空气中甲醛的最高容许浓度为0.08 mg/m3。
某研究性学习小组设计用如下方法测定某居室空气中甲醛的含量(假设空气中无其他还原性气体):
(1)测定原理:KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸。
反应的离子方程式为:![]()
![]()
(2)测定装置:部分装置如右图所示(a、b为止水夹)。
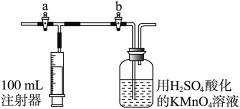
(3)实验步骤:
①检查装置气密性(气密性良好)。
②用__________(填仪器名称)准确移取25.00 mL 1.00×10-3 mol·L-1 的高锰酸钾溶液(过量)于广口瓶中并滴入3滴6 mol·L-1 H2SO4溶液备用。
③将2.00×10-3 mol·L-1的草酸标准溶液置于__________(填仪器名称)中备用。
④打开a,关闭b,用注射器抽取100 mL新装修的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次(共5次)。如果压送气体时速度过快,可能会产生什么不利后果?______________________________。
⑤将广口瓶中的溶液转入锥形瓶中(润洗广口瓶2~3次,并将洗涤液全部转入锥形瓶)。如果没有润洗,所测甲醛的含量将__________(填“偏高”“偏低”或“无影响”)。
⑥用草酸标准溶液滴定锥形瓶中的溶液,并记录滴定所消耗的草酸溶液体积。
本实验是否需要指示剂?(如果需要,请写出指示剂的名称;如果不需要,试说明终点时的实验现象)______________________________。
⑦再重复实验两次。
(4)数据处理:分别于装修完工后的第1天、第7天、第30天(室内始终保持通风换气状况)对室内空气进行取样,通过实验测得以下三组数据(每次实验所取的KMnO4溶液均为25.00 mL):
| 装置后 第n天 | 草酸溶液/mL | 甲醛的浓度mg/m3 | |||
| 1 | 2 | 3 | 平均值 | ||
| 1 | 15.86 | 15.72 | 15.67 | 15.75 | |
| 7 | 26.17 | 26.36 | 26.38 | 26.30 | |
| 30 | 30.90 | 30.67 | 30.81 | 30.79 | |
设KMnO4溶液的物质的量浓度为c1 mol·L-1,KMnO4溶液的体积为V1 mL;草酸溶液的物质的量浓度为c2 mol·L-1,草酸溶液的平均体积为V2 mL。
则:室内空气中甲醛浓度(mg/m3)的代数式为__________,第30天室内空气中甲醛浓度为__________(精确到小数点后两位),并判断此时主人__________(填“能”或“不能”)入住。




湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com