
题目列表(包括答案和解析)
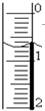 (I)滴定分析法是化学分析法中的重要分析方法之一.
(I)滴定分析法是化学分析法中的重要分析方法之一.| 滴定次数 实验数据(mL) |
1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
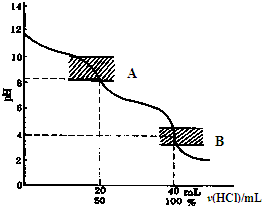
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | 常温下过氧化氢溶液不分解(或分解很少) ? ? |
| 实验二 | 在装有H2O2溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 木条复燃 | Al2O3能加快H2O2溶液的分解速率 Al2O3能加快H2O2溶液的分解速率 |

室温下,将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到了蓝色沉淀。为了确定沉淀的组成,某研究性学习小组进行了以下试验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3沉淀;
假设二:两者反应只生成Cu(OH)2沉淀;
假设三: ;
(二)【理论探究】
查阅资料:CuCO3和Cu(OH)2均不带结晶水;
KSP〔CuCO3〕=1.4×10-10 KSP〔Cu(OH)2〕=5.6×10-20
若只由此数据结合适当计算来判断,假设 是正确的。
(三)【实验探究】
步骤一:将CuSO4溶液倒入等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来,其操作方法为:①过滤 ,② ,③干燥。
步骤三:利用下图所示装置,进行定量分析:
① A装置中玻璃仪器的名称是 。
② 仪器组装好后首先要进行的实验操作是 。
③ 实验结束时通入过量的空气的作用是 。
④ 数据记录:
|
| B装置的质量(g) | C装置的质量(g) | D装置的质量(g) |
| 实验前 | 15.4 | 262.1 | 223.8 |
| 试验后 | 6.1 | 264.8 | 230.4 |
(四)【实验结论】
利用上述数据初步判断该沉淀的成分是CuCO3和Cu(OH)2,在沉淀中二者的物质的量之比为 。若所得沉淀是纯净物而不是混合物,请写出该物质的化学式 。
室温下,将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到了蓝色沉淀。为了确定沉淀的组成,某研究性学习小组进行了以下试验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3沉淀;
假设二:两者反应只生成Cu(OH)2沉淀; 假设三: ;
假设三: ;
(二)【理论探究】
查阅资料:CuCO3和Cu(OH)2均不带结晶水;
KSP〔CuCO3〕=1.4×10-10 KSP〔Cu(OH)2〕=5.6×10-20
若只由此数据结合适当计算来判断,假设 是正确的。
(三)【实验探究】
步骤一:将CuSO4溶液倒入等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来,其操作方法为:①过滤 ,② ,③干燥。
步骤三:利用下图所示装置,进行定量分析: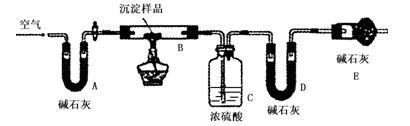
① A装置中玻璃仪器的名称是 。
② 仪器组装好后首先要进行的实验操作是 。
③ 实验结束时通入过量的空气的作用是 。
④ 数据记录:
| | B装置的质量(g) | C装置的质量(g) | D装置的质量(g) |
| 实验前 | 15.4 | 262.1 | 223.8 |
| 试验后 | 6.1 | 264.8 | 230.4 |
室温下,将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到了蓝色沉淀。为了确定沉淀的组成,某研究性学习小组进行了以下试验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3沉淀;
假设二:两者反应只生成Cu(OH)2沉淀;
假设三: ;
(二)【理论探究】
查阅资料:CuCO3和Cu(OH)2均不带结晶水;
KSP〔CuCO3〕=1.4×10-10 KSP〔Cu(OH)2〕=5.6×10-20
若只由此数据结合适当计算来判断,假设 是正确的。
(三)【实验探究】
步骤一:将CuSO4溶液倒入等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来,其操作方法为:①过滤 ,② ,③干燥。
步骤三:利用下图所示装置,进行定量分析:

① A装置中玻璃仪器的名称是 。
② 仪器组装好后首先要进行的实验操作是 。
③ 实验结束时通入过量的空气的作用是 。
④ 数据记录:
|
|
B装置的质量(g) |
C装置的质量(g) |
D装置的质量(g) |
|
实验前 |
15.4 |
262.1 |
223.8 |
|
试验后 |
6.1 |
264.8 |
230.4 |
(四)【实验结论】
利用上述数据初步判断该沉淀的成分是CuCO3和Cu(OH)2,在沉淀中二者的物质的量之比为 。若所得沉淀是纯净物而不是混合物,请写出该物质的化学式 。
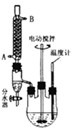 (2013?金华模拟)最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如下:
(2013?金华模拟)最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如下: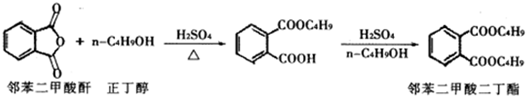

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com