
题目列表(包括答案和解析)
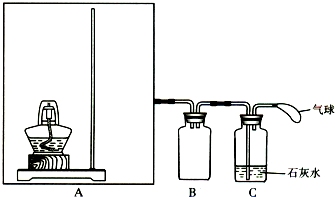
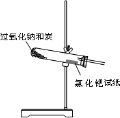

| ||


| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
(10分)如图所示的转化关系中,已知A是由短周期元素组成的酸式盐。D.Y.H为气体,X为无色液体,G和K均是常见的强酸。H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。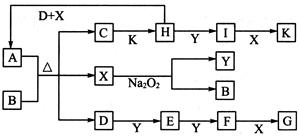
请回答下列问题:
(1)用电子式表示X的形成过程:____________________。
(2)写出D.H.X反应生成A的离子反应方程式:____________________。
(3)已知:2H(g)+Y(g)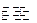 2I(g);
2I(g);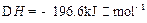 。当加入4 mol H和2 mol Y后,放出345 kJ的热量时,H的转化率最接近于__________(填字母)。
。当加入4 mol H和2 mol Y后,放出345 kJ的热量时,H的转化率最接近于__________(填字母)。
A.40% B.50% C.80% D.90%
(4)标准状况下在1000mL某密闭容器中装有440mL的C溶液,向其中加入3.9g Na2O2充分反应后恢复至原温度,发现容器内气体压强变为原来的1.5倍(忽略溶液体积变化),则原C溶液的物质的量浓度为__________mo1·L-1。(保留两位有效数字)
若以NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.加热时1 mol Fe与1 mol Cl2能恰好完全反应生成1 mol FeCl2,转移电子数为2NA
B.标准状况下,22.4L己烷中含碳原子数为6NA
C.30g甲醛中含共用电子对总数为3NA
D.3.9g Na2O2 与3.1g Na2O组成的混合物中所含离子总数为0.3NA
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温下,3.9g Na2O2与足量的水反应,转移的电子数为0.1 NA
B.100 mL 1 mol·L-1 Na2CO3溶液中含有的阴离子数大于0.1NA
C.25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
D.标准状况下,0.56 L的四氯化碳中含有的C—Cl数为0.1NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com