
题目列表(包括答案和解析)
“化学反应不管是一步完成还是分几步完成,其反应热是相同的。”这是著名的盖斯定律。今有18g焦炭(假定碳100%)发生不完全燃烧,所得气体中CO占![]() 体积,CO2占
体积,CO2占![]() 体积。已知
体积。已知
![]() 该反应放热Q1 kJ
该反应放热Q1 kJ
![]() 该反应放热Q2 kJ
该反应放热Q2 kJ
若与该18g焦炭完全燃烧相比,上述不完全燃烧损失的热量是
A.![]() B.2Q1kJ C.
B.2Q1kJ C.![]() D.Q2kJ
D.Q2kJ
图1-5-17是实验室制备TiCl4的反应装置,主要操作步骤为:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
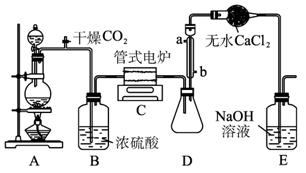
图1-5-17
试完成下列各题:
(1)正确的操作顺序为(填序号)_______________________________________________。
(2)装置A中的反应的离子方程式为__________________________________________。
(3)操作①的目的是_________________________________________________________。
(4)装置D中冷凝管进水口的位置是________(填a或b),装置E的作用是________________
____________________________________________________________________。
(5)TiCl4露置于空气中极易水解,其化学方程式可表示为_________________________。
(6)工业上常用金属镁在800℃和氩气氛围中还原TiCl4的方法制备钛,TiCl4+2Mg![]()
Ti+2MgCl2,氩气的作用为___________________________________________。

| ||
| ||
| ||
| ||


| ||
| ||
油条是一种深受群众喜爱的传统食品,在百姓早餐桌上一直占有重要位置。但油条中铝含量超标问题十分普遍,是影响群众健康的食品安全隐患。从2009年5月下旬开始,浙江省的油条加工停用含铝食品的添加剂,逐步转换为无铝添加剂配方和工艺,从而保证百姓吃上安全、放心的油条。油条无铝配方由碳酸氢钠(小苏打)、碳酸氢铵(臭粉)组成。为测定试样中WWW.K**S*858$$U.COM小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验。

实验过程:
①按图组装仪器,检查装置的气密性;
②将试样m1g放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量
为m2g、装置C的质量为m3g;
③打开活塞a,通N2一段时间后,关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
④称得装置B的质量为m4g、装置C的质量为m5g。
请回答以下问题:
(1)装置A中发生反应的化学方程式为 ,
。
(2)装置D的作用为防止空气中 进入装置C中。
装置C的作用为 。
(3)实验过程中第二次通入N2的目的是把装置中产生的 排出,使其被装置B和装置C完全吸收。
(4)用下列各项所提供的数据能计算出w(NaHCO3)的是( ) (填写序号)
| 序号 | a | b | c | d | e |
| 数据 | m1、m2、m3 | m2、m3、m4、m5 | m1、m2、m4 | m1、m4、m5 | m1、m3、m5 |
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的w(NaHCO3) (填“能”或“不能”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com