
题目列表(包括答案和解析)
(19分)已知A、B、C、D、E、F、C、H八种元素位于元素周期表前四个周期。A、B、C是三种非金属元素,A与B的原子的核外电子数之和与C原子的核外电子数相等且A、B、C能形成离子化合物。B与H位于同一主族,D的单质是中学化学常见的两性金属,E的单质是日常生活中用途最广泛的金属且其价电子数是G的两倍,F原子的最外电子层的p电子数是s电子数的两倍,D、H、F位于同一周期且原子序数依次增大,A、C、E、G、H的基态原子中未成对电子数均与其周期序数相同。请用化学用语回答以下问题:
(1)A、B、C形成的此化合物中存在的化学键的类型有 。E单质在常温下遇到A、B、C形成的另一化合物的浓溶液发生钝化现象,过量的E单质在此化合物的稀溶液中发生反应的离子方程式为 ,E的基态电子排布式为 ,E3+与E2+的稳定性大小为 。
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为 ,电负性由小到大的顺序为 。
(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的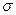 键和
键和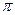 键的数目之比为 ;F、G对应的氢化物中键能大小为F—H键 G—H键。
键的数目之比为 ;F、G对应的氢化物中键能大小为F—H键 G—H键。
(4)等浓度、等体积的盐酸和氢氧化铀溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为 ,将所得溶液混合刚含有D元素的两种物质间发生反应的离子方程式为 。
(5)由A、C、F可形成两种酸类化合物,用离了方程式说明它们的酸性强弱 。由A、C、F与钠四种元素按原子个数比为l:3:1:1组成一种化合物,其水溶液硅酸性,则该溶液中各种离子的浓度由大到小的顺序为 ,向该溶液中滴入少量的氢氧化钡济液时发生反应的离子方程式为 。
已知A、B、C、D、E、F、C、H八种元素位于元素周期表前四个周期。A、B、C是三种非金属元素,A与B的原子的核外电子数之和与C原子的核外电子数相等且A、B、C能形成离子化合物。B与H位于同一主族,D的单质是中学化学常见的两性金属,E的单质是日常生活中用途最广泛的金属且其价电子数是G的两倍,F原子的最外电子层的p电子数是s电子数的两倍,D、H、F位于同一周期且原子序数依次增大,A、C、E、G、H的基态原子中未成对电子数均与其周期序数相同。请用化学用语回答以下问题:
(1)A、B、C形成的此化合物中存在的化学键的类型有 。E单质在常温下遇到A、B、C形成的另一化合物的浓溶液发生钝化现象,过量的E单质在此化合物的稀溶液中发生反应的离子方程式为 ,E的基态电子排布式为 ,E3+与E2+的稳定性大小为 。
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为 ,电负性由小到大的顺序为 。
(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的![]() 键和
键和![]() 键的数目之比为 ;F、G对应的氢化物中键能大小为F—H键 G—H键。
键的数目之比为 ;F、G对应的氢化物中键能大小为F—H键 G—H键。
(4)等浓度、等体积的盐酸和氢氧化铀溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为 ,将所得溶液混合刚含有D元素的两种物质间发生反应的离子方程式为 。
(5)由A、C、F可形成两种酸类化合物,用离了方程式说明它们的酸性强弱 。由A、C、F与钠四种元素按原子个数比为l:3:1:1组成一种化合物,其水溶液硅酸性,则该溶液中各种离子的浓度由大到小的顺序为 ,向该溶液中滴入少量的氢氧化钡济液时发生反应的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com