
题目列表(包括答案和解析)
已知:下表为25 ℃时某些弱酸的电离平衡常数。图像表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |

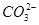
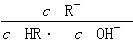 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)镁化合物和氯气均具有广泛用途,请回答下列问题:
(1)写镁和氯气反应产物的电子式________.
(2)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298 K时的稳定状态).则下列选项中正确的是________.
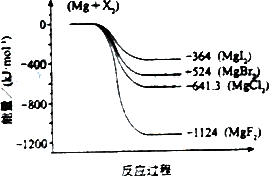
A.MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
B.Mg与X2的反应是放热反应
C.MgBr2与Cl2反应的ΔH<0
D.化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
(3)在298 K、100 Kpa时,在1 L水中可溶解0.09 mol氯气,实验测得溶于水的Cl2约有三分之一与水反应.请回答下列问题:
①该反应的离子方程式为________,平衡常数表达式为________
②在上述平衡体系中加入少量NaCl固体,平衡将________(填“正向移动”、“逆向移动”、“不移动”);增大氯气的压强,氯气的溶解度将________,氯气和水反应的平衡常数将________(填“变大”、“变小”、“不变”).
③已知:H2CO3![]() HCO3-+H+Ka1(H2CO3)=4.45×10-7HCO3-
HCO3-+H+Ka1(H2CO3)=4.45×10-7HCO3-![]() CO32-+H+Ka2(H2CO3)=5.61×10-11HClO
CO32-+H+Ka2(H2CO3)=5.61×10-11HClO![]() H++ClO-Ka(HClO)=2.95×10-8
H++ClO-Ka(HClO)=2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:将少量的氯气通入到过量的碳酸钠溶液中________;
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下: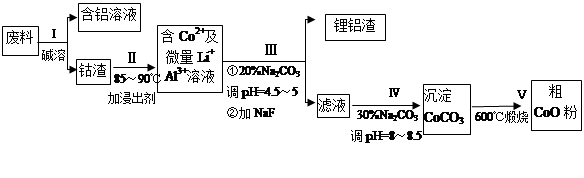
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式________ ____________。
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是 。
(4)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是___ ___(填序号)。
| A.c(Na+) = 2c(CO32-) |
| B.c(Na+) > c(HCO3-) > c(CO32-) |
| C.c(OH-) > c(HCO3-) > c(H+) |
| D.c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3) |
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下:

(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_______________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式____________________。
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是__________。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是______(填序号)。
A.c(Na+) = 2c(CO32-)
B.c(Na+) > c(CO32-) > c(HCO3-)
C.c(OH-) > c(HCO3-) > c(H+)
D.c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3)
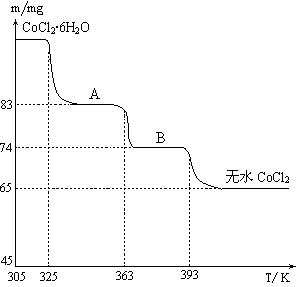
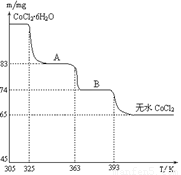
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com