
题目列表(包括答案和解析)
| 10-7y |
| x-y |
| 10-7y |
| x-y |
| 温度/℃CO2转化率/% n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |

 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011  CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022 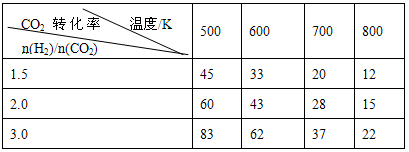
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011 CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022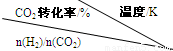 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
聚酯纤维是化学纤维中的第一大品种,聚已二酸乙二酯就是一种重要的聚酯纤维,可用于制造性能各异的聚氨酯泡沫塑料,弹性体、涂粘和粘接剂等。目前经典的合成路线是使用来源丰富的有机原料A和常见单质D,经过一系列反应,同时合成聚已二酸乙二酯与另一种生产生活中常用高聚物E,合成路线如下图所示。根据图示回答下列问题:
(1)写出E、G的结构简式:E ,G ;
(2)反应②的化学方程式(包括反应条件)是 。
反应④的反应条件是 ;
(3)写出①、⑤的反应类型:① ,⑤ 。
(4)满足下列构成条件的G的同分异构体有 种。
|
A.分子中有2个-COOH; B.分子中有1个—CH—,2个CH2—
(5)某同学查阅资料后提出,也可以用A与某种无机分子反应,直接得到F,该反应的原子利用率为100%,请写出该反应的化学方程式(不必注明反应条件)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com