
题目列表(包括答案和解析)
| |||||||||||
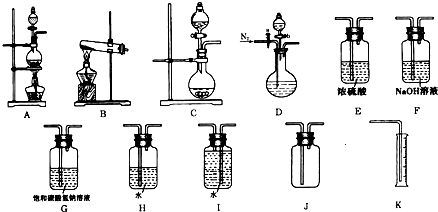
Ⅱ.实验室制备氨气,下列方法适宜选用的是_____________________。
①固态氯化铵加热分解 ②固体氢氧化钠中滴加浓氨水 ③氯化铵溶液与氢氧化钠溶液共热 ④固态氯化铵与氢氧化钙混合加热
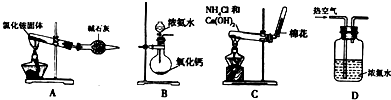
Ⅲ.为了在实验室利用工业原料制备少量氨气,有人设计了如图6-25装置(图中夹持装置均已略去)。

图6-25
实验操作:
①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗中注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气产生。在F出口处收集氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,放入水槽中,如图6-25所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通入氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是____________________________________________。
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是______________________,防止实验装置中压强过大。此时再打开弹簧夹b的原因是__________________________,C瓶内气体的成分是_______________________。
(3)在步骤③中,先加热铁触媒的原因是_________________。反应管E中发生反应,化学方程式是____________________________。
 CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.
CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.| C(HCO3-)C(OH-) |
| C(CO32-) |
| C(HCO3-)C(OH-) |
| C(CO32-) |
| 5 |
| 144 |
| 5 |
| 144 |
 CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.
CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com