在工业合成尿素时常用NH
3与CO
2作原料进行生产.
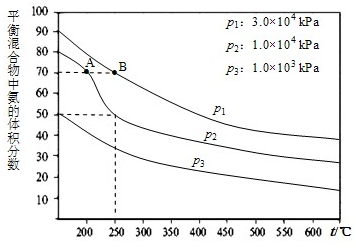
(1)右图为合成氨反应,氮气、氢气按体积比为1:3投料时不同温度和压强、使用相同催化剂条件下,平衡混合物中氨的体积分数图象.
①若分别用υ
A(NH
3)和υ
B(NH
3)表示从反应开始至达平衡状态A、B时的化学反应速率,则υ
A(NH
3)
υ
B(NH
3)(填“>”、“<”或“=”).
②在250℃、1.0×10
4kPa下,H
2的转化率为
%(计算结果保留小数点后1位).
③将0.02mol?L
-1氨水与0.01mol?L
-1的盐酸等体积混合,若反应后混合溶液显碱性,则反应混合液中各离子浓度由大到小的顺序为
.
(2)NH
3(g) 与CO
2(g) 经过两步反应生成尿素,两步反应的能量变化示意图如下:
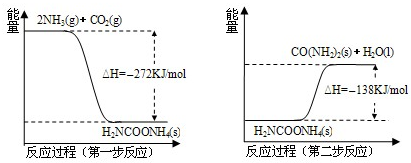
①NH
3(g) 与CO
2(g) 反应生成尿素的热化学方程式为
.
②工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有
.(填序号)
A.升高温度 B.加入催化剂 C.将尿素及时分离出去 D.增大反应体系的压强
(3)某实验小组模拟工业上合成尿素的条件,在一体积为0.5L的密闭容器中投入4mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如图所示:
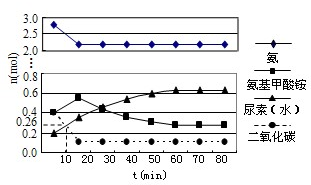
①已知总反应的速率通常由慢的一步反应决定,则合成尿素总反应的速率由第
步反应决定.
②反应进行到10min时测得CO
2的物质的量如图所示,则用CO
2表示的第一步反应的速率v(CO
2)=
.

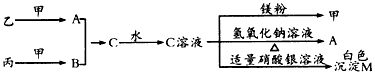
 在工业合成尿素时常用NH3与CO2作原料进行生产.
在工业合成尿素时常用NH3与CO2作原料进行生产.

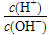 。25 ℃时,现有物质的量浓度为0.4 mol·L-1的HA溶液与0.2 mol·L-1的NaOH溶液等体积混合(溶液总体积近似等于两种溶液体积之和)。
。25 ℃时,现有物质的量浓度为0.4 mol·L-1的HA溶液与0.2 mol·L-1的NaOH溶液等体积混合(溶液总体积近似等于两种溶液体积之和)。