
题目列表(包括答案和解析)
2003年11月《环球时报》(美)报道,ACV浓缩饮料风靡全美,ACV具有解毒、降脂、减肥和止泻等多种疗效,其中苹果酸M(分子量134)是主要的活性物质,其化学成分及有关实验如下:
①含C35.82%(质量分数,下同),含H4.51%,其余为氧元素;
②各取1×10-3molM分别与足量NaHCO3反应放出CO244.8mL(标准状况,下同),与足量金属钠反应放出H233.6mL
③M分子中所有碳原子在同一链线上。
回答下列问题:
(1)M的化学式为: ,分子中含的官能团名称是 。
(2)已知M有多种同分异构体,试写出其中符合下述要求的结构简式(限写一种)。
1mol该有机物与足量金属钠反应生成1molH2: 。
|
(已知不能被O2氧化,但可与H2加成)
合成路线为:N→有机物A→有机物B→有机物C→M,其中B能发生银镜反应。
①有机物N的结构简式为 ;
②A转化为B的化学方程式为 。
③有机物C转化为M的反应类型为 。
(4)实验证明M分子间可形成具有水果香味的化合物,若该化合物分子中含有的环状结构,其结构简式可能为: 。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(8分)为了探究铁与氯气反应制取氯化铁的实验,某同学甲设计了如下的实验方案。其实验装置如下图,加热装置省略。已知:氯化铁易溶于水,熔、沸点低,受热易变为气态,而遇冷又易变为固态。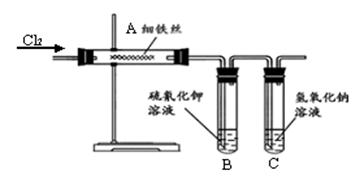
(1) 试管B中的现象是___________________,
试管B中的现象是___________________,
反应的离子方程式:____________________________ _。
(2)试管C中氢氧化钠溶液的作用___________________________________。
(3)某同学乙猜测铁与氯气反应可能还会生成氯化亚铁,为了探究生成物中是否含有氯化亚铁(假设铁已完全反应),请你设计实验方案
(4)氯化铁易溶于水,熔、沸点低,受热易变为气态,而遇冷又易变为固态,故认为甲同学上述实验装置有缺陷。你认为丙同学判断的依据是: 。
(15分)回答下列问题。
(1) 漂白粉与浓盐酸相遇时有黄绿色气体生成,若产生气体在标准状况下的体积为11.2L,则有 molHCl被氧化。
(2) 向氯水中加入CaCO3固体后,氯水的杀菌、漂白能力将 (填增强或减弱)其原因是 。
(3)二氧化硫气体与含1.5mol Cl元素的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种气态氯氧化物A,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是: 。
(4)我国卫生部已明确提出:要逐步用氯的氧化物A替代氯气进行饮用水的消毒。
①氯的氧化物A不稳定,可与NaOH溶液、H2O2反应,Cl元素转化为比较稳定的正三价物质,该反应的化学方程式为 。
② 用氯的氧化物A处理过的自来水中会残留少量A,可用FeCl2将其还原为。现用VL(已换算为标准状况) A处理一定量自来水,再加入a mol FeCl2可将残留的A恰好除去,则该自来水中残留A的物质的量为 。
(15分)回答下列问题。
(1) 漂白粉与浓盐酸相遇时有黄绿色气体生成,若产生气体在标准状况下的体积为11.2L,则有 molHCl被氧化。
(2) 向氯水中加入CaCO3固体后,氯水的杀菌、漂白能力将 (填增强或减弱)其原因是 。
(3)二氧化硫气体与含1.5 mol Cl元素的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种气态氯氧化物A,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是: 。
(4)我国卫生部已明确提出:要逐步用氯的氧化物A替代氯气进行饮用水的消毒。
①氯的氧化物A不稳定,可与NaOH溶液、H2O2反应,Cl元素转化为比较稳定的正三价物质,该反应的化学方程式为 。
② 用氯的氧化物A处理过的自来水中会残留少量A,可用FeCl2将其还原为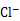 。现用VL(已换算为标准状况) A处理一定量自来水,再加入a mol FeCl2可将残留的A恰好除去,则该自来水中残留A的物质的量为
。
。现用VL(已换算为标准状况) A处理一定量自来水,再加入a mol FeCl2可将残留的A恰好除去,则该自来水中残留A的物质的量为
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com