
题目列表(包括答案和解析)
医用氯化钙可用于补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2·2H2O的质量分数为97.3-103.0%),工艺流程为:

(1)CaCO3与
盐酸反应的离子方程式________.(2)
除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中少量的Al3+、Fe3+.检验Fe(OH)3是否沉淀完全的实验操作是________.(3)过滤时需用的玻璃仪器除烧杯、玻璃棒外还有________.滤渣主要成分的化学式________.
(4)酸化时加盐酸的目的为:①________,②防止Ca2+在蒸发时发生水解.
(5)为什么蒸发结晶要保持在160℃:________.
(6)为测定样品中CaCl2·2H2O的含量,称取0.75 g样品并配成250 mL溶液,各取该溶液25.00 mL,分别置于三个锥形瓶中,用0.04 mol/L AgNO3溶液进行三次滴定,消耗AgNO3溶液的平均体积为20.00 mL.
①通过计算,样品中含CaCl2·2H2O的质量分数为________.
②若所测样品CaCl2·2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为________.
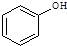 和
和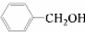 ,应选用
,应选用
| ||
| △ |
| ||
| △ |




| ||
| △ |
| ||
| △ |
| 水 |
| 自然风干 |

(12 分)
KClO3在农业上用作除草剂,超细CaCO3泛用于消光纸、无炭复写纸等。某同学在实验室模拟工业过程,利用制乙炔产生的残渣制备上述两种物质,过程如下:
①电石与水反应的化学方程式是__________。
②残渣中主要成分是Ca(OH)2和________。
II.将I中的部分灰浆配成池液,通人Cl2,得到Ca(Clo3)2与Cacl2物质的量之比为1:5的溶液,反应的化学方程式是________________
III.向II所得溶液中加人KCl,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得KClO3晶体。你认为能得到KClO3晶体的原因是________________。
IV.将I中的残渣溶于NH4Cl溶液,加热,收集挥发出的气体再利用。向所得CaCl2溶液中依次通入NH3、C02,便可获得超细CaCO3,过程如下:
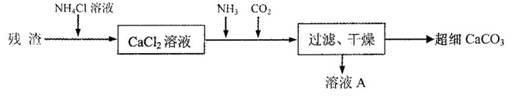
①根据沉淀溶解平衡原理,解释残渣中难溶盐的溶解原因________。
②CaCl2溶液中通入两种气体后,生成超细CaCO3的化学方程式是________。
③图示的溶液A可循环使用,其主要成分的化学式是________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com