中学化学常见物质A、B、C、D之间存在如下转化关系:A+B-C+D+H
2O(没有配平),请按要求填空:
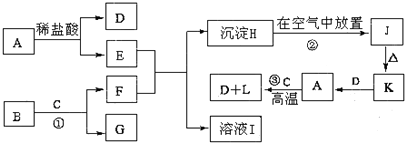
(1)若A为短周期组成的黑色固体物质,与B的浓溶液共热时,产生C、D两种气体.C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式是
C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O
C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O
,鉴别这两种气体不能选用的试剂是
A
A
.
A.氯化钡溶液 B.高锰酸钾溶液 C.品红溶液 D.酸化的硝酸钡溶液
向500ml 2mol/L的NaOH溶液中通入0.8mol无色无味的C气体,恰好完全反应,该反应的离子方程式是
4CO2+5OH-=CO32-+3HCO3-+2H2O
4CO2+5OH-=CO32-+3HCO3-+2H2O
.此时溶液中的离子浓度按照由大到小的顺序是
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
.
(2)若A在水中的溶解度随温度升高而降低,B为短周期非金属单质,D是漂白粉的成分之一.D发生水解反应的离子方程式是
ClO-+H2O?HClO+OH-
ClO-+H2O?HClO+OH-
.
(3)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体.检验A中阴离子的方法是
配成溶液,取少量溶液于试管中,滴加硝酸银溶液产生白色沉淀,再滴加稀硝酸沉淀不溶解
配成溶液,取少量溶液于试管中,滴加硝酸银溶液产生白色沉淀,再滴加稀硝酸沉淀不溶解
(简述操作过程及结论).

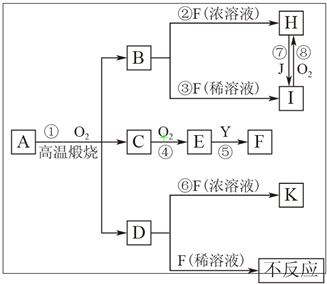 物质A由3种元素组成,在一定量O2中高温煅烧经复杂反应生成B、C、D的物质的量之比为1:2:1,D、J为常见金属,B、C为氧化物,Y为无色无味液体.物质A存在如下转化关系(有些反应的反应物和生成物中的水未标出):
物质A由3种元素组成,在一定量O2中高温煅烧经复杂反应生成B、C、D的物质的量之比为1:2:1,D、J为常见金属,B、C为氧化物,Y为无色无味液体.物质A存在如下转化关系(有些反应的反应物和生成物中的水未标出):