
题目列表(包括答案和解析)
单质硅是很重要的工业产品。
(1)硅用于冶炼镁,也称硅热法炼镁。根据下列条件:
Mg(s)+ 1/2O2(g)= MgO(s) △H1=-601.8 kJ/mol
Mg(s)= Mg(g) △H2=+75 kJ/mol
Si(s) + O2(g) = SiO2(s) △H3= -859.4 kJ/mol
则2MgO(s)+ Si(s)= SiO2(s)+ 2Mg(g) △H =
Mg-NiOOH水激活电池是鱼雷的常用电池,电池总反应是:Mg+2NiOOH+2H2O=Mg(OH)2+ 2Ni(OH)2,写出电池正极的电极反应式 。
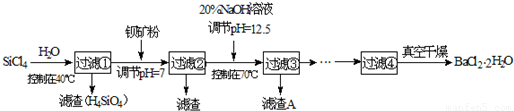
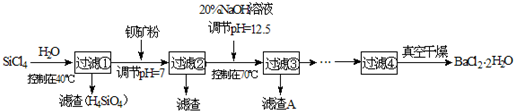
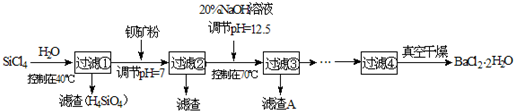
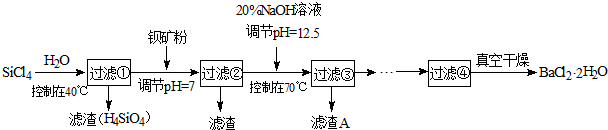
(2)制备多晶硅(硅单质的一种)的副产物主要是SiCl4,SiCl4对环境污染很大,遇水强烈水解,放出大量的热。研究人员利用SiCl4和钡矿粉(主要成分为BaCO3,且含有Fe3+、Mg2+等离子)制备BaCl2·2H2O和SiO2等物质。工艺流程如下:
已知: 25℃ Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mg(OH)2]=1.8×10-11;通常认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达完全。回答下列问题:
①SiCl4发生水解反应的化学方程式为_______________________________________。
②若加钡矿粉调节pH=3时,溶液中c(Fe3+)= 。
③若用10吨含78% BaCO3的钡矿粉,最终得到8.4吨BaCl2·2H2O (M=244g/mol),则产率为 。
④滤渣C能分别溶于浓度均为3mol/L的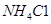 溶液和
溶液和 溶液(中性)。请结合平衡原理和必要的文字解释滤渣C能溶于3mol/L的
溶液(中性)。请结合平衡原理和必要的文字解释滤渣C能溶于3mol/L的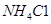 溶液的原因______。
溶液的原因______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com