
题目列表(包括答案和解析)
| 物质 | 室温下色、态 | 密度(g/ml) | 熔点(℃) | 沸点(℃) |
| 苯甲酸 | 白色固体 | 1.2659 | 122 | 249 |
| 甲醇 | 无色液体 | 0.7915 | -97.8 | 64.65 |
| 苯甲酸甲酯 | 无色液体 | 1.0888 | -12.3 | 199.6 |
| 乙酸 | 无色液体 | \ | 16.6 | 117.9 |
| 乙醇 | 无色液体 | \ | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | \ | 83.6 | 77.1 |

| 浓H2SO4 |
| △ |


化学方程式练习
一、用化学方程式表示下列各种物质的实验室制法
1、O2(三种方法):
2、H2:
3、Cl2:
4、NH3:
5、CO2:
6、NO:
二、用方程式表示工业生产过程(参考选修Ⅱ,带*的写离子方程式,注意反应条件)
1、氯碱工业(电解饱和食盐水)
*阳极:
*阴极:
*总反应:
2、接触法制硫酸(硫铁矿为原料)
①沸腾炉: ;其中氧化产物为:
②接触室: ;
V2O5的作用是 ,反应温度控制在400~500℃的原因是
③吸收塔:
用98%H2SO4吸收SO3而不用水直接吸收的原因是
。
④尾气处理:
3、海水提溴:
*①氯化:
②吹出
③吸收:
④转化:
4、合成氨:
①由水和碳合成H2
②合成塔:
5、氨氧化制硝酸
①氧化炉:
②吸收塔:
③制取化肥硝酸铵:
6、冶炼铝(冰晶石作熔剂)
①碱溶:
②沉淀:
③脱水:
④电解:*阳极:
*阴极:
总反应:
7、铝热法制铁
8、由三氧化钨制钨
9、工业制漂白粉
10、制玻璃
11、工业生产石灰浆
12、联合制碱法:
13、高纯硅的生产
。
14、炼铁炼钢
①还原剂的生成:
;
②铁的还原(将铁的氧化物,如Fe2O3还原):
③将生铁脱硫去磷降低含碳量即得钢。
三、完成下列反应的化学方程式(注意写反应条件)。
1、Fe + H2O(g)=
2、C+ H2O(g) =
3、CO+ H2O(g) =
4、F2+ H2O=
5、NH3+H2O
6、NO2+ H2O=
7、SO2+ H2O
8、Cl2 + H2O=
9、K + H2O=
10、Na2O2+ H2O=
11、CaC2+ H2O=
12、Mg3N2+ H2O =
13、Al + NaOH+ H2O=
14、CaCO3+ H2O+ CO2=
15、Fe(OH)2+ H2O+ O2=
16、FeCl3+ H2O
17、NH4Cl+H2O
18、Na2CO3+H2O
19、CuSO4+H2O电解
20、Na2S2O3 + HCl =
21、SiO2 + HF=
22、SiO2 + NaOH=
23、Na2SiO3+ HCl=
四、写出下列物质分别与NaOH溶液反应的化学方程式。
1、Si
2、Cl2
3、SiO2
4、SO2 (足量)
5、CO2(小量)
6、H3PO4
7、H2SO4
8、CH3Br
9、Al
10、Al2O3
11、AlCl3
12、Al(OH)3
13、CuSO4
14、NaHCO3
15、Ca(HCO3)2(足量)
16、(NH4)2SO4
五、写出下列物质受热或光照的化学方程式。
1、NaHCO3
2、HNO3
3、AgBr
4、H2SO3
5、NH4HCO3
6、Cu(OH)2
7、Ca(HCO3)2
8、Cu2(OH)2CO3
9、H2O2
10、KClO3
11、KMnO4
12、NH4Cl
13、HClO
14、CH4+Cl2
15、H2+Cl2
16、CuO
六、写出下列反应的化学方程式和离子方程式
1、SO2使溴水褪色:
2、SO2使酸性高锰酸钾溶液褪色:
3、氢氧化铁溶于氢碘酸:
4、乙二酸(草酸)使酸性高锰酸钾溶液褪色 :
5、用石灰水与小苏打溶液制烧碱:
6、硫酸氢铵与氢氧化钡溶液混合:
7、漂白粉溶液中充入足量CO2:
8、KHSO4与氢氧化钡溶液混合呈中性:
9、Fe3O4溶于稀硝酸:
10、明矾溶液中加Ba(OH)2溶液至沉淀量最大:
七、用离子方程式表示下列在溶液中的反应
1、KCl+AgNO3:
2、Ba(OH)2+H2SO4:
3、BaCO3+HCl:
4、Cu(OH)2+HCl:
5、Fe(OH)2+HNO3(稀) :
6、FeCl3+KSCN:
7、FeBr2+Cl2(物质的量之比为1:1):
8、NaBr+Cl2:
9、Fe+CuCl2:
10、Zn+AgNO3:
11、纯碱水解:
12、明矾净水:
13、铜和稀硝酸:
14、配制银氨溶液:
15、Na2O2投入稀硫酸中:
八、写出下列物质在空气中变质的化学方程式
1、Na2SO3:
2、NaOH:
3、NO:
4、Na:
5、Na2O2:
6、铜生锈:
7、氯水:
8、白磷:
9、稀硫酸酸化的FeSO4溶液变棕黄色
10、无色KI溶液变棕黄色
11、漂白粉失效:
九、写出下列反应的化学方程式
1、混合H2S和SO2生成硫和水:
2、炭加热放入浓硫酸中:
3、乙醇催化氧化为乙醛:
4、乙醛与银氨溶液反应:
5、乙醛与新制Cu(OH)2加热:
6、铜与浓硫酸共热:
7、氧化硫通入浓溴水:
8、铜与浓硝酸反应:
9、木炭和浓硝酸共热:
10、FeCl3溶液中加入KI溶液:
11、高锰酸钾固体中滴入浓盐酸:
12、氨水通入少量SO2:
13、偏铝酸钠溶液中加足量稀硫酸:
14、NaAlO2溶液中充入足量CO2:
15、Ba(AlO2)2溶液中加入硫酸铝溶液:
16、氢氧化亚铁水溶液在空气中变质:
12、氯化铁溶液溶解铜:
十、按要求写方程式
1、写出高温条件下发生的置换反应四个:
①
②
③
④
2、写出一个点燃条件下的置换反应:
3、写出一个加热条件下的置换反应:
4、写出一个有三种反应物的置换反应:
5、写出工业生产中需要高温条件的反应(不少于5个)的化学方程式:
6、试设计一个实验,检验某溶液中存在Fe2+,请在下面的横线上按操作顺序写出相应的离子方程式: 。
7、治疗胃酸过多的药物中常用Al(OH)3,如何用氧化铝制取氢氧化铝?要求制取过程中酸碱的用量降到最少。按生产顺序写出相关的离子方程式: 。
8、化学反应中有的具有相似性,有的反应具有特殊性,试写出下列相关化学方程式,并思考其中的原因:
① Li + O2
Na + O2
② Mg + CO2
Mg + SO2
③ Na2O2 + CO2
Na2O2 + SO2
KO2 + CO2
④ F2 + H2O
Cl2 + H2O
⑤ Fe + Cl2
Fe + I2
⑥ Fe(OH)3 + HCl
Fe(OH)3 + HI
9、按要求写化学方程式
①碱性氧化物与水反应(举2例)
②碱性氧化物与酸反应(举2例)
③金属氧化物但不是碱性氧化物的氧化物与水反应(举一例)
④酸性氧化物与水反应(举2例,其中一例为金属氧化物)
⑤能与水反应生成酸,但不是酸性氧化物也不是碱性氧化物氧化物与水反应的化学方程式:
。
⑥列举不少于5类既能与强酸反应,又能与强碱反应的物质,并分别写出它们与酸(HCl)、碱(NaOH)反应的离子方程式:
A、物质化学式:
B、物质化学式:
C、物质化学式:
D、物质化学式:
E、物质化学式:
F、物质化学式:
G、物质化学式:
10、某酸性氧化物,它能与某些酸反应,也能与碱反应,请写出这样的氧化物一种,并写出它与酸反应的化学方程式和与碱反应的离子方程式:
氧化物分子式:
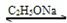 CH3COCH2COOC2H5+C2H5OH
CH3COCH2COOC2H5+C2H5OH| 回流 |
| 振荡② |
| 回收有机液体③ |
| 加入乙酸乙酯④ |
| 乙酸酸化⑤ |
| ⑥ |
| ⑦ |
| 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 | |
| 密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点(℃) | 881.4 | 80 | 111 | 138.4 | 76.8 |
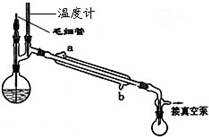
| 无水硫酸钠 |
| 过滤 |
| 水浴蒸馏 |
| 减压蒸馏 |
绿矾(FeSO4?7H2O)是治疗缺铁性贫血的特效药。某学校的化学兴趣小组的同学对绿矾进行了如下的探究:
FeSO4?7H2O的制备
该化学兴趣小组的同学在实验室通过如下实验由废铁屑(含少量氧化铜、氧化铁等杂质)制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去
Na2CO3溶液,然后将废铁屑用水洗涤2~3遍。
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 。
(2)实验步骤②明显不合理,理由是 。
(3)为了洗涤除去晶体表面附着的硫酸等杂质,实验步骤④中用少量冰水洗涤晶体,原因是 。
(二)探究绿矾(FeSO4·7H2O)热分解的产物
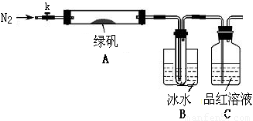 已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
【实验过程】
①仪器连接后,检查装置A与B气密性;
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热硬质玻璃管;
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色;
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取少量滴入几滴KSCN溶液,溶液变红色;
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
(4)实验结果分析
结论1:B中收集到的液体是?????????????????? ;
结论2:C中溶液褪色,可推知产物中有???? ?????????????? ;
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足:??????????????????????????? 。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,选用一种试剂鉴别,该试剂最合适的是?????????? 。
a.氯水和KSCN溶液???? b.酸性KMnO4溶液????? c.H2O2???? d.NaOH溶液
绿矾(FeSO4?7H2O)是治疗缺铁性贫血的特效药。某学校的化学兴趣小组的同学对绿矾进行了如下的探究: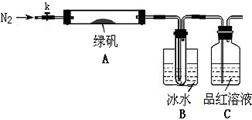
FeSO4?7H2O的制备
该化学兴趣小组的同学在实验室通过如下实验由废铁屑(含少量氧化铜、氧化铁等杂质)制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去
Na2CO3溶液,然后将废铁屑用水洗涤2~3遍。
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 。
(2)实验步骤②明显不合理,理由是 。
(3)为了洗涤除去晶体表面附着的硫酸等杂质,实验步骤④中用少量冰水洗涤晶体,原因是 。
(二)探究绿矾(FeSO4·7H2O)热分解的产物
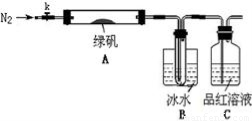
已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):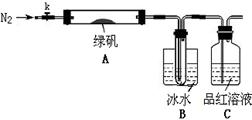
【实验过程】
①仪器连接后,检查装置A与B气密性;
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热硬质玻璃管;
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色;
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取少量滴入几滴KSCN溶液,溶液变红色;
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
(4)实验结果分析
结论1:B中收集到的液体是 ;
结论2:C中溶液褪色,可推知产物中有 ;
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足: 。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,选用一种试剂鉴别,该试剂最合适的是 。
a.氯水和KSCN溶液 b.酸性KMnO4溶液 c.H2O2 d.NaOH溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com