
题目列表(包括答案和解析)
| 高温 |
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
①
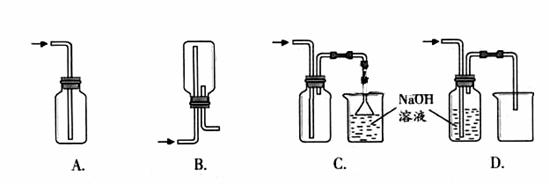 |
②将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 。ks5u
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,
(2)能量之间可以相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
 限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
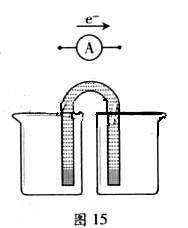
① 完成原电池的甲装置示意图(见图15),并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
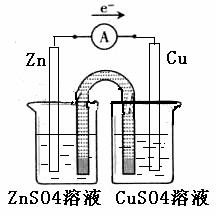
② 以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 。
③ 甲乙两种原电池中可更有效地将化学能转化为电能的是 ,其原因是 。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选 作阳极。
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。完成下列填空:
23.铝原子核外电子云有 种不同的伸展方向,有 种不同运动状态的电子。
24.镓(Ga)与铝同族。写出镓的氯化物和氨水反应的化学方程式。
25.硅与铝同周期。SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 。
长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为
26.用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO![]() 3Ba↑+BaO·Al2O3
3Ba↑+BaO·Al2O3
常温下Al的金属性比Ba的金属性 (选填“强”“弱”)。利用上述方法可制取Ba的主要原因是 。
a.高温时Al的活泼性大于Ba b.高温有利于BaO分解
c.高温时BaO·Al2O3比Al2O3稳定 d.Ba的沸点比Al的低
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。完成下列填空:
(1)铝原子核外电子云有 种不同的伸展方向,有 种不同运动状态的电子。
(2)镓(Ga)与铝同族。写出镓的氯化物和氨水反应的化学方程式。
(3)硅与铝同周期。SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 。
长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为
(4)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO 3Ba↑+BaO·Al2O3
3Ba↑+BaO·Al2O3
常温下Al的金属性比Ba的金属性 (选填“强”“弱”)。利用上述方法可制取Ba的主要原因是 。
a.高温时Al的活泼性大于Ba b.高温有利于BaO分解
c.高温时BaO·Al2O3比Al2O3稳定 d.Ba的沸点比Al的低
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
①下列收集Cl2的正确装置是 。
②将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 。
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中, 。
(2)能量之间可以相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池甲的装置示意图(见图15),并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
②铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 。
③甲乙两种原电池中可更有效地将化学能转化为电能的是 ,其原因是 。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选 作阳极。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com