
题目列表(包括答案和解析)
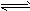 2HR1+Na2CO3;HR和HR1的酸性强弱比较,正确的是
2HR1+Na2CO3;HR和HR1的酸性强弱比较,正确的是 A.HR较弱 B.HR′较弱
C.两者相差不大 D.无法比较
A.HR较弱 B.HR′较弱 C.两者相差不大 D.无法比较
有两种一元弱酸的钠盐溶液,其物质的量浓度相等.现向这两种盐的溶液中分别通入适量的CO2,发生的反应如下:NaR+CO2+H2O=HR+NaHCO3;2NaR'+CO2+H2O=2HR'+Na2CO3.比较HR和HR'酸性的强弱,正确的是
[ ]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com