
题目列表(包括答案和解析)
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40℃ | 10ml | 10ml | 40s |
| 40℃ | 20ml | 20ml |
(16分)草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。草酸的盐可用作碱土金属离子的广谱沉淀剂。
(1)40 ℃时混合一定体积的0.1 mol/L H2C2O4溶液与一定体积0.01 mol/L酸性KMnO4溶液,填写表中空格。
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40 ℃ | 10 ml | 10 ml | 40 s |
| 40 ℃ | 20 ml | 20 ml |
|
(2)用甲基橙作指示剂,通过酸碱滴定可测定草酸溶液浓度。甲基橙是一种常用的酸碱指示剂,甲基橙(用化学式HIn表示)本身就是一种有机弱酸,其电离方程式为:HInH++In—。则酸根离子In—的颜色是 。甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断)。
(3)常温下有pH均为3的盐酸和草酸溶液各10 ml,加水稀释,在答题卷上画出稀释过程中两种溶液中c(H+)变化的示意图并作必要的标注。
(4)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5 mol/L时可认为该离子已沉淀完全。现为了沉淀1 L0.01 mol/LMgCl2溶液中的Mg2+,加入100 mL0.1 mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全。
(5)(NH4)2C2O4溶液因NH4+水解程度稍大于C2O42-而略显酸性,0.1 mol/L(NH4)2C2O4溶液pH值6.4。现有某未知溶液,常温下由水电离出的c(H+)=1.0×10-5 mol/L,该溶液pH可能是 (填字母)。
A.5 B.6 C.7 D.9
(15分)草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的性质,某化学研究性学习小组查阅了有关资料,有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 化学性质 |
| H2C2O4 | 189.5℃ | 有毒,具有腐蚀性,易溶于水,二元弱酸。 100℃开始升华,157℃时开始分解。 草酸与浓硫酸混合加热产生CO2、CO和H2O。 草酸钙和草酸氢钙均为白色不溶物 |
[实验一]根据下图提供的仪器和试剂(可重复使用),设计实验证明草酸的受热分解产物中含有CO2和CO(部分夹持仪器和加热装置省略)
(1)用字母表示接口的正确连接顺序。
a→b→c→( )→()→d→e→( )→( )→( )→( )→尾气处理
(2)用上图提供的仪器和试剂做实验时,装置B中出现白色浑浊,也不能说明一定有CO2,原因是 ;请你提出改进意见 。
(3)利用改进后装置进行的实验时,要先加热 装置,(填“A”、“B”、“C”、“D”、“E”,下同)后加热 装置;能证明分解产物中有CO的实验依据是 。
[实验二] 探究草酸与酸性高锰酸钾的反应
(4) 向草酸溶液中逐滴加入硫酸酸化高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,可推测草酸可能具有 。
(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化高锰酸钾溶液时,溶液褪色总是先慢后快。为探究其原因,同学们做了如下的对比实验:
| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(S) (g) | 褪色时间 (S) | ||
| C(mol·L-1) | V(mL) | C(mol·L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
该对比实验的结论是 。
(16分)草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。草酸的盐可用作碱土金属离子的广谱沉淀剂。
(1)40 ℃时混合一定体积的0.1 mol/L H2C2O4溶液与一定体积0.01 mol/L酸性KMnO4溶液,填写表中空格。
|
温度 |
v(H2C2O4) |
v(KMnO4) |
KMnO4褪色时间 |
|
40 ℃ |
10 ml |
10 ml |
40 s |
|
40 ℃ |
20 ml |
20 ml |
|
(2)用甲基橙作指示剂,通过酸碱滴定可测定草酸溶液浓度。甲基橙是一种常用的酸碱指示剂,甲基橙(用化学式HIn表示)本身就是一种有机弱酸,其电离方程式为:HIn H++In—。则酸根离子In—的颜色是
。甲基橙的酸性与草酸相比,
(填前者强、前者弱、十分接近、无法判断)。
H++In—。则酸根离子In—的颜色是
。甲基橙的酸性与草酸相比,
(填前者强、前者弱、十分接近、无法判断)。
(3)常温下有pH均为3的盐酸和草酸溶液各10 ml,加水稀释,在答题卷上画出稀释过程中[来源:Z*xx*k.Com]两种溶液中c(H+)变化的示意图并作必要的标注。
(4)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5 mol/L时可认为该离子已沉淀完全。现为了沉淀1 L0.01 mol/LMgCl2溶液中的Mg2+,加入100 mL0.1 mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全。
(5)(NH4)2C2O4溶液因NH4+水解程度稍大于C2O42-而略显酸性,0.1 mol/L(NH4)2C2O4溶液pH值6.4。现有某未知溶液,常温下由水电离出的c(H+)=1.0×10-5 mol/L,该溶液pH可能是 (填字母)。
A.5 B.6 C.7 D.9
(15分)草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的性质,某化学研究性学习小组查阅了有关资料,有关物质的部分性质如下表:
|
物质 |
熔点/℃ |
化学性质 |
|
H2C2O4 |
189.5℃ |
有毒,具有腐蚀性,易溶于水,二元弱酸。 100℃开始升华,157℃时开始分解。 草酸与浓硫酸混合加热产生CO2、CO和H2O。 草酸钙和草酸氢钙均为白色不溶物 |
[实验一]根据下图提供的仪器和试剂(可重复使用),设计实验证明草酸的受热分解产物中含有CO2和CO(部分夹持仪器和加热装置省略)
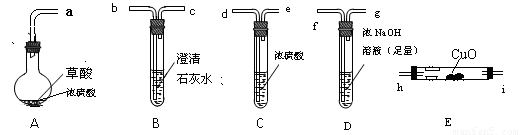
(1)用字母表示接口的正确连接顺序。
a→b→c→( )→( )→d→e→( )→( )→( )→( )→尾气处理
(2)用上图提供的仪器和试剂做实验时,装置B中出现白色浑浊,也不能说明一定有CO2,原因是 ;请你提出改进意见 。
(3)利用改进后装置进行的实验时,要先加热 装置,(填“A”、“B”、“C”、“D”、“E”,下同)后加热 装置;能证明分解产物中有CO的实验依据是 。
[实验二] 探究草酸与酸性高锰酸钾的反应
(4) 向草酸溶液中逐滴加入硫酸酸化高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,可推测草酸可能具有 。
(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化高锰酸钾溶液时,溶液褪色总是先慢后快。为探究其原因,同学们做了如下的对比实验:
|
实验序号 |
H2C2O4(aq) |
KMnO4(H+)(aq) |
MnSO4(S) (g) |
褪色时间 (S) |
||
|
C(mol·L-1) |
V(mL) |
C(mol·L-1) |
V(mL) |
|||
|
实验1 |
0.1 |
2 |
0.01 |
4 |
0 |
30 |
|
实验2 |
0.1 |
2 |
0.01 |
4 |
5 |
4 |
该对比实验的结论是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com